Бессмертные клетки HeLa
Анна Старокадомская
«Популярная механика» №4, 2014
В большую науку эти клетки попали совершенно неожиданно. Они были взяты у женщины по имени Генриетта Лакс (HEnrietta LAcks), которая вскоре после этого умерла. Но культура клеток убившей ее опухоли оказалась незаменимым инструментом для ученых.
В биомедицинских исследованиях и при разработке новых видов лечения часто используют выращенные в лаборатории культуры человеческих клеток. Среди множества клеточных линий одна из самых известных — HeLa. Эти клетки, имитирующие организм человека in vitro («в пробирке»), «вечны» — они могут бесконечно делиться, результаты исследований с их использованием достоверно воспроизводятся в разных лабораториях. На своей поверхности они несут достаточно универсальный набор рецепторов, что позволяет использовать их для исследования действия различных веществ, от простых неорганических до белков и нуклеиновых кислот; они неприхотливы в культивировании и хорошо переносят заморозку и консервацию.
Генриетта Лакс
Генриетта Лакс была красивой чернокожей американкой. Она жила в небольшом городке Тернер в Южной Виргинии вместе с мужем и пятью детьми. 1 февраля 1951 года Генриетта обратилась в госпиталь Джонса Хопкинса — ее беспокоили странные выделения, которые она периодически обнаруживала на своем нижнем белье. Медицинский диагноз был страшен и беспощаден — рак шейки матки. Восемь месяцев спустя, несмотря на хирургию и радиотерапию, она умерла. Ей был 31 год.
Пока Генриетта лежала в госпитале Хопкинса, лечащий врач отправил полученные с помощью биопсии клетки опухоли на анализ Джорджу Гею — руководителю лаборатории исследования клеток тканей в госпитале Хопкинса. В то время культивирование клеток вне организма было только на стадии становления, и главной проблемой была неизбежная гибель клеток — после определенного количества делений вся клеточная линия погибала.
Оказалось, что клетки, обозначенные «HeLa» (акроним имени и фамилии Генриетты Лакс), размножались гораздо быстрее клеток из нормальных тканей. Кроме того, злокачественная трансформация сделала эти клетки бессмертными — у них отключилась программа подавления роста после определенного количества делений.
Кроме того, злокачественная трансформация сделала эти клетки бессмертными — у них отключилась программа подавления роста после определенного количества делений.
Действительно, никогда до этого момента исследователи не могли считать результаты, полученные на клеточных культурах, полностью достоверными: все опыты проводились на разнородных клеточных линиях, которые в конце концов погибали — иногда даже прежде, чем удавалось получить какие-нибудь результаты. И тут ученые стали обладателями первой стабильной и даже вечной (!) клеточной линии, адекватно имитирующей свойства организма. А когда обнаружилось, что клетки HeLa способны пережить даже пересылку по почте, Гей разослал их своим коллегам по всей стране. Очень скоро спрос на клетки HeLa вырос, и их растиражировали в лабораториях по всему миру. Они стали первой «шаблонной» клеточной линией.
Так получилось, что Генриетта умерла именно в тот день, когда Джордж Гей выступал перед телевизионными камерами, держа в руках пробирку с ее клетками. Он заявил, что началась эпоха новых перспектив в поиске лекарств и медико-биологических исследованиях.
Он заявил, что началась эпоха новых перспектив в поиске лекарств и медико-биологических исследованиях.
Почему ее клетки так важны?
И он был прав. Линия клеток, идентичная во всех лабораториях мира, позволила быстро получать и независимо подтверждать всё новые и новые данные. Можно смело сказать, что гигантский прыжок молекулярной биологии в конце прошлого века был обусловлен возможностью культивировать клетки

С момента смерти Генриетты Лакс клетки ее опухоли непрерывно использовались для исследования молекулярных закономерностей развития самых разных заболеваний, в том числе рака и СПИДа, для изучения воздействия радиации и токсичных веществ, составления генетических карт и огромного количества других научных задач. В мире биомедицины клетки HeLa стали столь же известны, как лабораторные крысы и чашки Петри. В декабре 1960 года клетки HeLa первыми полетели в космос в советском спутнике. Даже сегодня поражает размах экспериментов, проводившихся тогда советскими генетиками в космосе. Результаты показали, что HeLa хорошо себя чувствуют не только в земных условиях, но и в невесомости.
Без клеток линии HeLa стала бы невозможной разработка вакцины против полиомиелита, созданной Джонасом Солком. Кстати, Солк был настолько уверен в безопасности полученной вакцины (ослабленного вируса полиомиелита), что в доказательство надежности своего лекарства вколол вакцину себе, своей жене и троим детям.
С тех пор HeLa использовали и для клонирования (предварительные опыты по пересадке клеточных ядер перед клонированием знаменитой овцы Долли проводились на HeLa), для отработки методов искусственного оплодотворения и тысяч других исследований (некоторые из них приведены в таблице).
Помимо науки…
Личность самой Генриетты Лакс долгое время не афишировалась. Для доктора Гея, конечно, происхождение клеток HeLa не было тайной, но он полагал, что конфиденциальность в этом вопросе является приоритетом, и в течение многих лет семья Лакс не знала, что клетки Генриетты прославились на весь мир. Тайна раскрылась только после смерти доктора Гея в 1970 году.
 Оказалось, что HeLa могут перемещаться с частицами пыли в воздухе или на недостаточно тщательно вымытых руках и приживаться в культурах других клеток. Это вызвало большой скандал. В надежде решить проблему путем генотипирования (секвенирование — полное прочтение генома — в то время пока еще только планировалось как грандиозный международный проект), одна группа ученых разыскала родственников Генриетты и попросила образцы ДНК семьи, для того чтобы составить карту генов. Таким образом тайное и стало явным.
Оказалось, что HeLa могут перемещаться с частицами пыли в воздухе или на недостаточно тщательно вымытых руках и приживаться в культурах других клеток. Это вызвало большой скандал. В надежде решить проблему путем генотипирования (секвенирование — полное прочтение генома — в то время пока еще только планировалось как грандиозный международный проект), одна группа ученых разыскала родственников Генриетты и попросила образцы ДНК семьи, для того чтобы составить карту генов. Таким образом тайное и стало явным.Кстати, американцы и сейчас переживают больше по поводу того, что семья Генриетты так и не получила компенсацию за использование клеток HeLa без согласия донора. По сей день семья живет в не очень-то хорошем достатке, и материальная помощь была бы очень кстати. Но все запросы упираются в глухую стену — ответчиков давно уж нет, а Медицинская академия и другие научные структуры предсказуемо не желают обсуждать эту тему.
11 марта 2013 года масла в огонь подлила новая публикация, где были представлены результаты полного сиквенса генома клеточной линии HeLa. Опять же, эксперимент был проведен без согласия потомков Генриетты, и после непродолжительных этических споров полный доступ к геномной информации был разрешен только для профессионалов. Тем не менее, полный геномный сиквенс HeLa имеет огромное значение для последующих работ, позволяя использовать клеточную линию в будущих геномных проектах.
Опять же, эксперимент был проведен без согласия потомков Генриетты, и после непродолжительных этических споров полный доступ к геномной информации был разрешен только для профессионалов. Тем не менее, полный геномный сиквенс HeLa имеет огромное значение для последующих работ, позволяя использовать клеточную линию в будущих геномных проектах.
Реальное бессмертие?
Злокачественная опухоль, убившая Генриетту, сделала ее клетки потенциально бессмертными. Хотела ли эта женщина бессмертия? И получила ли она его? Если задуматься, возникает фантастическое ощущение — часть живого человека, искусственно размноженная, терпит миллионы испытаний, «пробует на вкус» все лекарства перед тем, как они попадут в испытания на животных, раздраконивается до самых что ни на есть основ молекулярными биологами во всем мире…
Конечно, всё это не имеет никакого отношения к «жизни после жизни». Глупо полагать, что в клетках HeLa, беспрестанно мучимых ненасытными учеными, существует хоть какая-то частичка души несчастной молодой женщины. Тем более что человеческими эти клетки можно считать лишь отчасти. В ядре каждой клетки HeLa — от 76 до 82 хромосом из-за происшедшей в процессе озлокачествления трансформации (нормальные человеческие клетки содержат 46 хромосом), и эта полиплоидность периодически вызывает споры о пригодности клеток HeLa как модели человеческой физиологии. Было даже предложено выделить эти клетки в отдельный, близкий человеку вид, под названием
Тем более что человеческими эти клетки можно считать лишь отчасти. В ядре каждой клетки HeLa — от 76 до 82 хромосом из-за происшедшей в процессе озлокачествления трансформации (нормальные человеческие клетки содержат 46 хромосом), и эта полиплоидность периодически вызывает споры о пригодности клеток HeLa как модели человеческой физиологии. Было даже предложено выделить эти клетки в отдельный, близкий человеку вид, под названием
Тем не менее исследователи всегда помнят об ограничениях, которые необходимо иметь в виду. Во-первых, HeLa, несмотря на все изменения, всё еще остаются человеческими клетками: все их гены и биологические молекулы соответствуют человеческим, а молекулярные взаимодействия в подавляющем большинстве случаев идентичны биохимическим путям здоровых клеток. Во-вторых, полиплоидия делает эту линию более удобной для геномных исследований, так как количество генетического материала в одной клетке увеличено, и результаты получаются более четкими и контрастными. В-третьих, широкое распространение клеточных линий по миру позволяет без проблем повторять опыты коллег и использовать опубликованные данные как фундамент для собственных исследований. Установив основные факты на модели HeLa (а все помнят, что это хоть удобная, но только модель организма), ученые пытаются повторить их на более адекватных модельных системах. Как видно, HeLa и подобные им клетки представляют собой фундамент для всей науки и сегодня. И, несмотря на этические и моральные споры, сегодня хочется почтить память этой женщины, поскольку ее невольный вклад в медицину неоценим: клетки, оставшиеся после нее, спасли и продолжают спасать больше жизней, чем это может сделать любой врач.
В-третьих, широкое распространение клеточных линий по миру позволяет без проблем повторять опыты коллег и использовать опубликованные данные как фундамент для собственных исследований. Установив основные факты на модели HeLa (а все помнят, что это хоть удобная, но только модель организма), ученые пытаются повторить их на более адекватных модельных системах. Как видно, HeLa и подобные им клетки представляют собой фундамент для всей науки и сегодня. И, несмотря на этические и моральные споры, сегодня хочется почтить память этой женщины, поскольку ее невольный вклад в медицину неоценим: клетки, оставшиеся после нее, спасли и продолжают спасать больше жизней, чем это может сделать любой врач.
Благодарим портал biomolecula.ru за помощь в подготовке статьи
См. также:
Ребекка Склут «Бессмертная жизнь Генриетты Лакс».
Расшифровка генома «бессмертных» клеток HeLa привела к скандалу в США
Затем научная группа из Университета Вашингтона в Сиэттле (США) под руководством Джея Шендура (Jay Shendure) также составила расшифровку генома HeLa и нашла причину, по которой у Лакс развился рак. Они изучили включения генов папилломавируса человека в геном HeLa. Этот вирус и сам несет набор генов, способствующих развитию рака, кроме того, он встроился рядом с онкогеном, мутации в котором приводят к развитию раковых опухолей. Ученые полагают, что близость генов папилломавируса к онкогену была причиной развития у Лакс очень агрессивной формы рака.
Они изучили включения генов папилломавируса человека в геном HeLa. Этот вирус и сам несет набор генов, способствующих развитию рака, кроме того, он встроился рядом с онкогеном, мутации в котором приводят к развитию раковых опухолей. Ученые полагают, что близость генов папилломавируса к онкогену была причиной развития у Лакс очень агрессивной формы рака.«Это, наверное, самый худший вариант того, как папилломавирус мог встроиться в ее геном», — пояснил один из авторов исследования Эндрю Эдей (Andrew Adey) из Университета Вашингтона.
Исследования без разрешения
В середине XX века ученым не требовалось разрешение самой Генриетты или ее родственников на использование клеток в исследованиях. Поэтому долгое время члены семьи Лакс не подозревали, какую роль сыграли клетки Генриетты в развитии науки. Однако узнав об использовании клеток HeLa в исследованиях, ее родственники были возмущены тем, что все это происходило без их ведома.
Новый виток развития тема получила в марте 2012 года, когда Штайнмец и его коллеги выложили расшифровку генома клеток HeLa в базы данных, доступные научному сообществу.
Результаты расшифровки геномов обычных людей нельзя публиковать вместе с их личными данными. Но в случае HeLa ученые не нарушили никаких законов и не увидели в этом ничего предосудительного: эти клетки давно стали привычным объектом исследований. Однако семья Лакс была возмущена. Несмотря на отличия HeLa от здоровых человеческих клеток, они могут выявить некоторые наследственные черты семьи. Расшифровка генома была удалена из баз данных, однако это не решило проблему.
Результаты исследования генома клеток HeLa, проведенные группой Шендура, были приняты к печати в журнале Nature. Это подразумевает обязательную публикацию данных исследования. Проблема конфиденциальности расшифровки генома HeLa снова стала актуальной.
Чтобы найти выход из этой ситуации, Фрэнсис Коллинз (Francis Collins), директор, и Кэти Хадсон (Kathy Hudson), замдиректора Национального института здоровья США встретились с представителями семьи Лакс. Вместе они решили опубликовать расшифровку генома HeLa, ограничив к ней доступ. Ученые, которые захотят ознакомится с этими данными, должны будут обратиться в Национальный институт здоровья, где их запрос будут рассматривать, в том числе, представители семьи Лакс. Таким образом Лаксы будут знать, кто и для каких целей использует эти данные, и смогут определять условия их использования. Исследование Шендура стало первым, которое опубликовано с согласия Лаксов.
Ученые, которые захотят ознакомится с этими данными, должны будут обратиться в Национальный институт здоровья, где их запрос будут рассматривать, в том числе, представители семьи Лакс. Таким образом Лаксы будут знать, кто и для каких целей использует эти данные, и смогут определять условия их использования. Исследование Шендура стало первым, которое опубликовано с согласия Лаксов.
Конечно, остается возможность восстановить геном HeLa по данным, опубликованным за годы исследования клеток, или расшифровать его заново и снова выложить в интернет. Национальный институт здоровья США не сможет повлиять на тех исследователей, работу которых он не финансирует, пишут руководители института в том же выпуске Nature, где опубликовано исследование Шендура. Однако они призвали научное сообщество уважать права семьи Лакс.
Изменения в законодательстве
Этот случай — уникальный, подчеркивает руководство Национального института здоровья, и поэтому рассматривается в индивидуальном порядке. Однако он привлек внимание общественности к условиям использования биологических образцов в научных исследованиях.
Однако он привлек внимание общественности к условиям использования биологических образцов в научных исследованиях.
Действующие законы США оставляют возможность получить на основании такого образца полную расшифровку генома человека без его ведома. Единственное ограничение — образец должен быть анонимным. Однако в век компьютерной обработки данных такая защита весьма условна, признает руководство Национального института здоровья.
«Кроме того, взаимоотношения между учеными и участниками исследований развиваются: запрос разрешения подчеркивает, что участники — это партнеры (ученых), а не просто предмет изучения», — пишут Коллинз и Хадсон.
Сейчас руководство Национального института здоровья готовит предложения поправок в американские законы. Если эти изменения будут приняты, ученым придется получать у «доноров» биологических тканей разрешение на использование материала вне зависимости от анонимности исследования.
Читайте также: сколько потребуется времени на телепортацию человека, зачем нужна модель гибели человечества после нашествия зомби, каков возраст «Адама» и «Евы» и многое другое в свежем выпуске еженедельной рубрики «Научный понедельник» на ria. ru >>
ru >>
кто помог раскрыть тайну коронавируса
Образцы, давшие начало клеточной линии, взяли в США ровно семьдесят лет назад у больной раком женщины Генриетты Лакс.
СУХУМ, 8 фев — Sputnik. Разработка вакцины от полиомиелита, выявление связи рака с вирусом папилломы человека, открытие механизма проникновения SARS-CoV-2 в клетку — всем этим мы обязаны культуре клеток HeLa, широко применяемой в лабораториях по всему миру. Читайте в материале Татьяны Пичугиной для РИА Новости.
Имя засекреченоВ феврале 1951 года в клинику Джонса Хопкинса обратилась молодая женщина — Генриетта Лакс. Ее беспокоили кровянистые выделения в дни отсутствия месячных. При осмотре врач обнаружил 23-сантиметровую опухоль шейки матки. Ничего подобно он раньше не видел. Биопсия показала, что это рак — эпидермальная карцинома.
Джордж Джей, руководитель лаборатории исследования клеток тканей при клинике Хопкинса, давно искал подходящую модель, на которой можно испытывать лекарства от рака. При повторном визите Генриетты он взял образцы опухоли для исследования, не уведомив пациентку, что было обычно в те времена.
При повторном визите Генриетты он взял образцы опухоли для исследования, не уведомив пациентку, что было обычно в те времена.
Джей размножил опухолевые клетки из образца и увидел: колония живет и развивается. Выделив одну клетку, ученый дал начало первой линии, которая могла бесконечно расти в лаборатории и служить моделью для разных экспериментов. Он назвал ее HeLa, зашифровав первые буквы имени Генриетты Лакс.
По иронии судьбы 4 октября 1951 года, в день, когда Джордж Джей показал на телевидении клеточную линию HeLa, Генриетта Лакс скончалась в больнице. Ей шел тридцать второй год. Дома в городе Тернер в Южной Вирджинии, где она работала на табачном поле, остались муж и пятеро детей. А ее клетки живут и поныне. Они очень неприхотливы и устойчивы, переносят длительную заморозку и консервацию. Сейчас их культивируют в тысячах лабораторий.
Причину аномальности HeLa поняли гораздо позже. В 1961 году американский ученый Леонард Хейфлик показал, что в лабораторных условиях обычные здоровые клетки человека начинают стареть примерно через 50 делений, а затем погибают.
Количество делений зависит от длины окончаний хромосом — теломеров: чем старше организм, тем они короче. Ограничение на число делений называют пределом Хейфлика. Преодолеть его для обычных клеток на искусственной питательной среде не удается до сих пор. У раковых же клеток этот предел отсутствует.
Противоречия вокруг HeLaСпустя десяток лет после создания линии HeLa выяснилось, что клетки могут заражать другие колонии, перемещаясь по воздуху или, например, на грязных руках. В те годы еще не выработали стандарты стерильности, что приводило к многочисленным ошибкам в экспериментах.
В 1970-е появились вопросы и к их генетической чистоте. Ученым пришлось разыскать семью Генриетты и взять образцы у потомков, чтобы составить карту генов. Родственники были поражены, что клетки до сих пор живы, — и смущены тем, что их взяли без ее согласия.
В 1976 году в журнале Rolling Stone вышла статья с историей Генриетты Лакс. Тогда впервые широкая общественность узнала имя человека, чьи клетки дали начало бессмертной линии HeLa. Это породило этическую дилемму, особенно с учетом того, что женщина была афроамериканкой.
Это породило этическую дилемму, особенно с учетом того, что женщина была афроамериканкой.
Этический вопрос вновь всколыхнул научный мир в 2010-м, после выхода книги «Бессмертные клетки Генриетты Лакс» американской журналистки Ребекки Склут, где история описана с точки зрения членов ее семьи.
В 2013-м ученые расшифровали геном киотской версии линии HeLa для проекта ENCODE. Вместо 46 хромосом, как в обычных клетках, в них обнаружили лишние копии — всего от 76 до 80 хромосом, большинство сильно измененных. Многие гены в них тоже многократно дублированы, иногда по пять-шесть раз. Было ли так в самом первом образце, сейчас сказать невозможно. Но это могло послужить причиной агрессивного рака у Лакс.
Тогда же авторы отозвали статьи с расшифровками генома HeLa из соображений приватности. Национальные институты здоровья США пришли к соглашению: геном будут хранить в базе данных под контролем рабочей группы, куда войдут и родственники Генриетты. Чтобы использовать клетки, нужно согласиться с условиями семьи Лакс и, кроме того, упоминать ее в научных публикациях.
Клеточная линия HeLa позволила стандартизировать научные исследования, сравнивать между собой результаты разных экспериментов. Открытия не заставили себя ждать.
В 1953 году выяснилось, что HeLa хорошо заражаются тремя вирусами полиомиелита. Это помогло разработать инактивированную вакцину — американский вирусолог Джонас Солк тестировал ее именно на клетках HeLa. Впоследствии препарат применяли во всем мире.
В 1960-е HeLa участвовали в космических экспериментах на советских аппаратах «Восток». В начале нулевых их отправили на станцию «Мир», чтобы изучить повреждение генома космической радиацией.
В 1984 году ученые из Германии обнаружили в нескольких раковых линиях, включая HeLa, вирус папилломы человека — HPV18. И выдвинули версию, что клетки переродились именно из-за этой инфекции. За доказательство гипотезы в 2008-м руководитель исследований Харальд цур Хаузен получил Нобелевскую премию. Сейчас известно, что этот вирус в ответе за большинство случаев рака шейки матки.
В самом начале эпидемии COVID-19 ученые пытались понять, как коронавирус проникает в клетки, обманывая мембранную защиту.
Для этого использовали различные линии, в том числе HeLa. Было известно, что SARS-CoV, «старший брат» SARS-CoV-2, цепляется к рецептору ACE2 на мембране и входит в нее. Возможно, такой же механизм работает и с новым коронавирусом. Выяснилось, однако, что SARS-CoV-2 плохо заражает HeLa, поскольку синтезирует мало рецептора. Тогда китайские ученые изменили геном так, что клетки стали выделять на поверхности полноразмерный белок ACE2 и впускать с его помощью вирус. Так исследователи доказали, что это и есть входные ворота для инфекции.
Сейчас клеточная линия HeLa служит для испытаний вакцин-кандидатов против COVID-19, изучения спайк-белка, которым коронавирус цепляется за мембрану, анализа РНК-генома разных коронавирусов в человеческих клетках — и участвует во множестве других исследований.
По грубым оценкам, за все время существования HeLa ученые вырастили более 50 миллионов тонн клеток и опубликовали более 70 тысяч статей с результатами, полученными с помощью этой линии. В 2017 году американский художник Кадир Нельсон назвал Генриетту Лакс «матерью современной медицины».
В 2017 году американский художник Кадир Нельсон назвал Генриетту Лакс «матерью современной медицины».
Культура клеток HeLa: бессмертное наследие Генриетты Лакс
Красивая чернокожая американка Генриетта Лакс (рис. 1),
потомок белых плантаторов и их черных рабов, одна из дочерей в семье с десятком детей, проживала в небольшом городке Тернер в Южной Вирджинии вместе с мужем и 5 детьми. 1 февраля 1951 г. Генриетта Лакс поступила в гинекологическое отделение госпиталя Дж. Хопкинса: ее беспокоили странные кровянистые выделения в межменструальном периоде. При осмотре была обнаружена 23 см опухоль шейки матки. После проведения биопсии был выставлен диагноз: «эпидермальная карцинома шейки матки». Восемь месяцев спустя, несмотря на оперативное лечение и радиационную терапию, в возрасте 31 года она умерла [4, 5].
В ходе обследования лечащий врач отправил биопсию ее опухоли на анализ Джорджу Гею (George Gey), руководителю лаборатории исследования клеток и тканей при университете Джонса Хопкинса (Балтимор, Штат Мэриленд), который занимался проблемой лечения рака и поиском бессмертной клеточной линии человека для научных исследований (рис. 2).
Он первым открыл необыкновенные свойства этих опухолевых клеток, которым было суждено стать первой человеческой культурой. Ему удалось выделить одну конкретную клетку, нарастить ее и начать клеточную линию. Он запустил процесс размножения клеток Лакс, создав бессмертную клеточную линию, в отличие от нормальных популяций клеток, имеющих «предел Хейфлика». Вскоре Джордж Гей обнаружил, что клетки HeLa способны пережить даже пересылку по почте, и разослал их своим коллегам по всей стране. Очень скоро спрос на клетки HeLa вырос, и их растиражировали в лабораториях по всему миру. Они стали первой в мире стандартной клеточной линией, которая пролиферировала необычайно быстро и была более устойчивой даже в сравнении с другими раковыми клетками [5].
1 сентября 1951 г. Джордж Гей, держа в руках пробирку с клеточной культурой HeLa, выступал перед телевизионными камерами. Он заявил, что благодаря полученной клеточной линии в медико-биологических научных исследованиях началась новая эпоха, открывающая невиданные перспективы в разработке новых лекарственных препаратов и что не далек тот день, когда будет найдено лекарство от рака. Генриетта Лакс умерла в госпитале Хопкинса 4 октября 1951 г., а популяция ее клеток продолжала свой безудержный рост, значительно опережая развитие биоэтических норм и правил, необходимых для регулирования научного прогресса.
Почему ее клетки так важны?
Джордж Гей был прав. Действительно, клетки HeLa стали долгожданным событием для исследователей всего мира. Эта популяция клеток, идентичная во всех лабораториях мира, позволила ученым быстро получать и независимо друг от друга подтверждать все новые и новые данные. Можно смело сказать, что гигантский прыжок молекулярной биологии в конце прошлого века был обусловлен возможностью культивировать клетки in vitro. Клетки HeLa — первые бессмертные человеческие клетки, которые когда-либо были выращены на искусственной питательной среде. Они дали возможность ученым культивировать сотни других линий раковых клеток. И хотя до сих пор не найдено условий для культивирования нетрансформированных клеток, раковые клетки в большинстве своем являются адекватной моделью для поиска ответов на вопросы, задаваемые учеными и медиками.
В отличие от обычной популяции человеческих клеток, которые делятся от 40 до 50 раз, прежде чем умереть, клетки HeLa способны делиться бесконечно.
Нормальные клетки человека имеют кариотип, состоящий из 46 хромосом, в то время как клетки HeLa — от 76 до 80 хромосом, в значительной степени мутированных [6]. Появление этого отклонения от нормального кариотипа связано с вирусом папилломы человека (ВПЧ) HPV18, ответственного почти за все случаи рака шейки матки. ВПЧ «вставляет» свою ДНК в клетку-хозяина, в результате чего она начинает синтезировать протеин, который связывается и инактивирует белок p53, известный как хранитель генома из-за его роли в пред-отвращении мутации и подавлении опухоли. Поэтому инактивация белка р53 может иметь катастрофические последствия [7].
Даже по сравнению с другими раковыми клетками клетки HeLa растут чрезвычайно быстро. В свое время доктор Дж. Гей был поражен, увидев, что в течение 24 ч культивирования своего первого образца HeLa количество клеток удвоилось. Причиной этой аномалии служит активность фермента теломеразы HeLa. Так, в процессе деления нормальной клетки повторяющиеся короткие последовательности ДНК на концах всех хромосом, известные как теломеры, сокращаются вследствие снижения активности данного фермента [8]. Это приводит к старению и, в конечном счете, к апоптозу и гибели клеток. Нормальные клетки имеют максимальное количество делений прежде, чем эти теломеры истощаются. А в клетках HeLa, за счет высокой активности теломеразы, теломеры удлиняются, достигая при этом неограниченной репликативной возможности [9]. Эта аномалия позволяет клеткам HeLa делиться бесконечно, что делает их сейчас старше возраста Генриетты на момент ее смерти.
Этой клеточной культуре ученый мир обязан многими замечательными достижениями. Например, без клеток HeLa была бы невозможна разработка в 1953 г. вирусологом Национального фонда детского паралича Джонасом Солком (Jonas Salk) вакцины против полиомиелита из инактивированных вирусов [4]. Это был большой и многообещающий научный успех, но прежде чем применять новый препарат на людях, его необходимо было испытать на живых человеческих клетках. Популяция клеток HeLa оказалась совершенным инструментом. Они не только быстро росли, что позволяло своевременно накопить огромное количество клеток, необходимых для исследования, но и, как оказалось, легко заражались вирусом полиомиелита. Менее чем за 1 год вакцина была готова для применения на пациентах [10].
После успешного использования клеток HeLa для получения вакцины вируса полиомиелита линии культур клеток человека стали незаменимыми для выделения и культивирования ряда других вирусов, производства антител, интерферона, противоопухолевых химиопрепаратов. С тех пор список прорывных технологий и достижений с использованием клеток HeLa стал постоянно пополняться. Они повсе-дневно используются для вирусологических исследований, изучения таких заболеваний, как рак, СПИД, для оценки воздействия радиации и токсичных веществ, составления генетических карт, развития методов клеточной инженерии и решения огромного количества других научных задач [5].
В конце 60-х годов XX века НеLa и другие клеточные культуры дали толчок для возникновения генетической инженерии (условно относят к 1972 г.), когда в США П. Бергом (Paul Naim Berg) и его коллегами из Стэнфордского университета была создана первая рекомбинантная молекула ДНК. Открылась возможность целенаправленно конструировать искусственные генетические программы и многие нужные лекарственные препараты [11].
В декабре 1960 г. клетки HeLa полетели в космос на советском космическом аппарате «Спутник-6», в последующем они побывали в космосе еще несколько раз. Результаты показали, что HeLa хорошо себя чувствуют не только в земных условиях, но и в невесомости. С тех пор HeLa применяли для клонирования (в том числе знаменитой овечки Долли), многочисленных генетических исследований, отработки методов искусственного оплодотворения и для тысяч других исследований. С 1972 г. эти клетки активно используются в международной программе совместной борьбы с раком, при участии медиков всего мира [5].
Благодаря клеткам HeLa была выявлена связь ВПЧ и раком шейки матки, а также роль теломеразы в пред-отвращении деградации хромосом. За это Харальд цур Хаузен в 2008 г. и Элизабет Блэкберн, Кэрол Грейдер и Джек Шостак в 2011 г. были удостоены двух Нобелевских премий [12, 13].
«Мать вирусологии, клеточных и тканевых технологий, биотехнологии, современной медицины» — вот далеко не полный перечень эпитетов, которые заслужила за многие десятилетия эта клеточная культура.
Таким образом, невольный вклад Генриетты Лакс в медицину бесценен, за более чем полувековое служение науке и человечеству клеточная культура HeLa стала неоценимой и неотъемлемой частью биомедицинских исследований (рис. 3).
Рис. 3. История использования клеток в молекулярной биологии и медицине (рисунок авторов).А тем временем…
А тем временем личность самой Генриетты Лакс долгое время не афишировалась. Доктор Гей, конечно, знал о происхождении клеток HeLa, но он считал, что конфиденциальность в этом вопросе является приоритетной, и в течение многих лет никто, и в том числе семья Лакс, не знал, что это именно ее клетки прославились на весь мир [5].
После смерти доктора Джорджа Гея в 1970 г. тайна раскрылась. Это произошло случайно. На заре зарождения технологий исследований с помощью клеточных культур многие ученые не уделяли должного внимания стандартам стерильности при работе с клетками и возможности перекрестного заражения многочисленных клеточных линий [4]. Более агрессивные и живучие клетки HeLa заражали менее сильные клеточные культуры, перемещаясь по воздуху с частицами пыли или на нестерильных инструментах, недостаточно тщательно вымытых руках, одежде [4, 5]. Спустя 25 лет ученые обнаружили, что чистота культуры клеток HeLa оказалась под вопросом — одна и та же клеточная линия в различных лабораториях имела разные генетические характеристики [14]. Возникшую проблему было решено исправить путем генотипирования, для чего ученые разыскали родственников Генриетты и попросили дать им образцы ДНК семьи, чтобы составить карту генов. Таким образом тайное и стало явным.
При этом в течение нескольких десятилетий согласие на эксплуатацию клеток самой Г. Лакс и ее родственников игнорировалось. Небогатая семья Генриетты так и не получила компенсацию за применение клеток HeLa без согласия донора, а материальная помощь ее многочисленным родственникам, не имевшим средств на оплату медицинского обслуживания, была бы очень кстати. Но все запросы упираются в глухую стену, ответчиков давно уж нет [5, 15]. В 2013 г. ее родственники впервые получили авторское право на использование клеточного материала своей прабабушки в научно-популярных публикациях. От всякой денежной награды семья отказалась. В это же время было принято соглашение между Национальными институтами здравоохранения США (NIH) и членами семьи Генриетты о помещении последовательности генома HeLa «в базу данных с контролируемым доступом», то есть в базу данных NIH о генотипах и фенотипах (dbGaP; http://www.ncbi.nlm.nih.gov/gap)». В настоящее время ученым необходимо обратиться в NIH для использования данных в своих исследованиях, согласившись с выдвигаемыми условиями. Также по закону требуется, чтобы семья Lacks была упомянута в любых научных публикациях [16].
Хотелось бы отметить, что некоторыми учеными клетки HeLa были вынесены в отдельный вид, не относящийся к человеческому — Helacyton gartleri (Hela, в честь самих клеток HeLa; cyton, от греческого цитоса, что означает клетка; и gartleri — в честь генетика Стэнли Гартлера, который первым задокументировал поразительные свойства этих клеток). Эволюционный биолог Ли Ван Вален относит клетки HeLa к новому микробному виду из-за их не-ограниченного деления, собственного клонального кариотипа, хромосомной несовместимости с людьми, разной экологической ниши и способности выживания вне человеческого тела. Однако многие с этим не согласны, так как считают выживание клеток HeLa искусственным явлением и утверждают, что эволюция в чашке Петри мало влияет на эволюцию в природе [17]. В парках, скверах и городах, созданных людьми, живет большое количество микро- и макроорганизмов, адаптированных к этим условиям, добавляет Ван Вален. Так, человеком были искусственно созданы новые виды, хотя и не от своей собственной плоти. Если бы HeLa не был получен из человеческой ткани, утверждает Ван Вален, не было бы никаких сомнений в том, что его выделили бы в новый вид [18, 19].
Тем не менее образец раковой опухоли, ради любопытства помещенный в питательную среду, стал быстро размножаться, не стареет, и вот уже 65 лет активно используется в науке. В наше время клеточная культура HeLa — это важный научный инструмент многих исследовательских лабораторий, благодаря ему были проведены тысячи исследований, защищены диссертации, опубликованы более 70 тыс. научных статей и получены более 11 тыс. патентов. На сегодняшний день их настолько много, что если бы Генриетта была жива, то их вес в общем количестве в десятки раз превысил бы вес самой женщины, которая, к сожалению, так и не узнала о том, какой бесценный, хоть и невольный вклад она внесла в науку.
Поэтому хочется почтить память Генриетты Лакс. Ее клетки — оставшееся после нее бессмертное наследие, спасли и продолжают спасать жизней больше, чем в силах сделать любой врач.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Ляпун И.Н. — e-mail: [email protected]; https://orcid.org/0000-0002-5290-3864
Андрюков Б.Г. — e-mail: [email protected]; https://orcid.org/0000-0003-4456-808X
Бынина М.П. — e-mail: [email protected]; https://orcid.org/0000-0001-8255-328X
Автор, ответственный за переписку:
Андрюков Б.Г. — e-mail: [email protected]
Как цитировать:
Ляпун И.Н., Андрюков Б.Г., Бынина М.П. Культура клеток HeLa: бессмертное наследие Генриетты Лакс. Молекулярная генетика, микробиология и вирусология. 2019;37(4):151-157. https://doi.org/10.17116/molgen201937041
Бессмертные клетки Генриетты Лакс
В биомедицинских исследованиях и при разработке новых видов лечения часто используют выращенные в лаборатории культуры человеческих клеток. Среди множества клеточных линий одной из самых известных является HeLa — клетки эндотелия матки. Эти клетки, имитирующие упрощенного «человека» в лабораторных исследованиях, являются «вечными» — они могут бесконечно делиться, переносить десятки лет в морозилке, могут быть поделены на части в разных пропорциях. На своей поверхности они несут достаточно универсальный набор рецепторов, что позволяет использовать их для исследования действия различных цитокинов; они очень не прихотливы в культивировании; они очень хорошо переносят заморозку и консервацию. В большую науку эти клетки попали совершенно неожиданно. Они были взяты у женщины по имени Генриетта Лакс, которая вскоре после этого умерла. Рассмотрим всю историю подробнее.
Генриетта Лакс
Рисунок 1. Генриетта Лакс с мужем Дэвидом.
Генриетта Лакс была красивой чернокожей американкой. Она жила в небольшом городке Тернер в Южной Вирджинии вместе с мужем и пятью детьми. 1 февраля 1951 года Генриетта Лакс обратилась в госпиталь Джонса Хопкинса — её беспокоили странные выделения, которые она периодически обнаруживала на своём нижнем белье. Медицинский диагноз был страшен и беспощаден — рак шейки матки. Восемь месяцев спустя, несмотря на хирургию и радиационное облучение, она умерла. Ей был 31 год.
Пока Генриетта находилась в госпитале Хопкинса, лечащий врач отправил её опухоль (цервикальная биопсия) на анализ Джорджу Гею (George Gey) — начальнику лаборатории исследования клеток тканей в госпитале Хопкинса. Напомним, что в то время культивирование клеток вне организма было только на стадии становления, и главной проблемой была предопределённая гибель клеток — после определенного количества делений вся клеточная линия погибала.
Оказалось, что клетки, обозначенные «HeLa» (акроним имени и фамилии Henrietta Lacks), размножались вдвое быстрее клеток из нормальных тканей. Такого прежде не происходило ни с какими другими клетками in vitro. Кроме того, трансформация сделала эти клетки бессмертными — у них отключилась программа подавления роста после определенного количества делений. Это открывало небывалые перспективы в биологии.
Действительно, никогда до этого момента исследователи не могли считать результаты, полученные на клеточных культурах, столь достоверными: раньше все опыты проводились на разнородных клеточных линиях, которые в конце концов погибали — иногда прежде, чем удавалось получить какие-нибудь результаты. И тут ученые получили первую стабильную и даже вечную (!) клеточную линию, достаточно адекватно имитирующую сущность организма. А когда обнаружилось, что клетки HeLa способны пережить даже пересылку по почте, Гей разослал их своим коллегам по всей стране. Очень скоро спрос на клетки HeLa вырос, и их растиражировали в лабораториях по всему миру. Они стали первой «шаблонной» клеточной линией.
Так получилось, что Генриетта умерла именно в тот день, когда Джордж Гей выступал перед телевизионными камерами, держа в руках пробирку с её клетками, и заявил, что началась новая эпоха в медицинских исследованиях — эпоха новых перспектив в поиске лекарств и исследовании жизни.
Почему её клетки так важны?
И он был прав. Линия клеток, идентичная во всех лабораториях мира, позволила быстро получать и независимо подтверждать всё новые и новые данные. Можно смело сказать, что гигантский прыжок молекулярной биологии в конце прошлого века был обусловлен возможностью культивировать клетки in vitro. Клетки Генриетты Лакс стали первыми бессмертными человеческими клетками, которые когда-либо были выращены на искусственной питательной среде. HeLa научили учёных культивировать сотни других линий раковых клеток. И, хотя до сих пор не найдено условий для культивирования нетрансформированных клеток, раковые клетки в большинстве своём являются адекватной моделью для поиска ответов на вопросы, задаваемые учёными и медиками.
Без клеток линии HeLa стала бы невозможной разработка вакцины против полиомиелита, созданной Джонасом Солком (Jonas Salk). Кстати, Солк был настолько уверен в безопасности полученной вакцины (ослабленного вируса полиомиелита), что в доказательство надёжности своего лекарства сначала вколол вакцину себе, своей жене и троим детям.
С момента смерти Генриетты Лакс клетки её опухоли непрерывно использовалась для исследования таких заболеваний как рак, СПИД, для изучения воздействия радиации и токсичных веществ, составления генетических карт и огромного количества других научных задач. В биомедицинском мире клетки HeLa стали столь же известны, как лабораторные крысы и чашки Петри. В декабре 1960 года клетки HeLa первыми полетели в космос в советском спутнике. Кстати, даже сегодня поражает размах экспериментов, проводимых тогда советскими генетиками в космосе (см. врезку).
Результаты показали, что HeLa хорошо себя чувствуют не только в земных условиях, но и в невесомости. С тех пор HeLa использовали и для клонирования (предварительные опыты по пересадке ядер перед клонированием знаменитой овцы Долли проводились на HeLa), и для составления генетических карт, и для отработки искусственного оплодотворения, и тысяч других исследований (см. рисунок 2).
Рисунок 2. Исследования, проведённые с помощью клеток линии HeLa.
Космическая генетика в СССР
На третьем космическом корабле-спутнике (01.12.1960 г.) в полёт отправились ещё больше живых объектов: две собаки — Пчёлка и Мушка, две морские свинки, две белые лабораторные крысы, 14 чёрных мышей линии С57, семь мышей-гибридов от мышей СБА и С57 и пять белых беспородных мышей. Там же поместили шесть колб с высокомутабельной и семь колб с низкомутабельной линиями дрозофил, а также шесть колб с гибридами. Кроме того, две колбы с мухами были покрыты дополнительной защитой — слоем свинца толщиной 5 г/см2. Помимо этого на корабле находились семена гороха, пшеницы, кукурузы, гречихи, конские бобы. В специальном лотке летали проростки семян лука и нигеллы. На борту корабля имелись несколько пробирок с актиномицетами, ампулы с культурой ткани человека в термостате и вне термостата, шесть пробирок с хлореллой в жидкой среде. В эбонитовых патронах находились запаянные ампулы с бактериальной культурой кишечной палочки и двумя разновидностями фага — Т3 и Т4. В специальных устройствах содержались культура клеток HeLa, лёгочная амниотическая ткань человека, фибробласты, клетки костного мозга кролика, а также контейнер с икрой и спермой лягушки. Были размещены также вирусы табачной мозаики различных штаммов, вирус гриппа.
Из статьи Н. Делоне «У истоков космической генетики» («Наука и Жизнь», № 4, 2008).
Помимо науки…
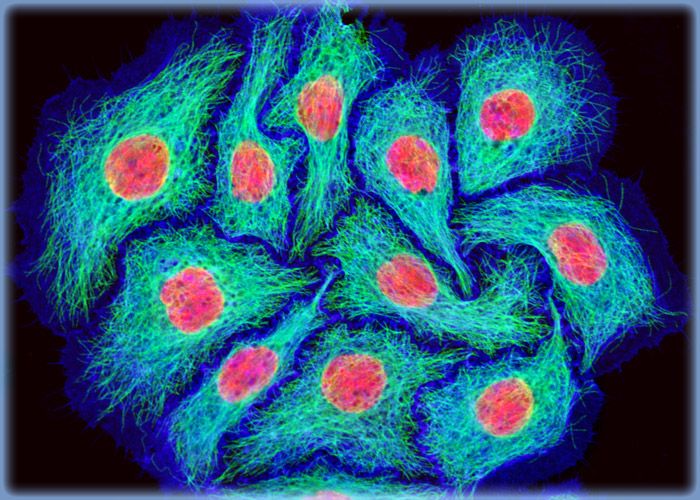
Рисунок 3. Клетки HeLa под сканирующим микроскопом в псевдоцветах.
Личность самой Генриетты Лакс долгое время не афишировалась. Доктор Гей, конечно, знал о происхождении клеток HeLa, но он полагал, что конфиденциальность в этом вопросе является приоритетом, и в течение многих лет семья Лакс не знала, что это именно её клетки прославились на весь мир. После смерти доктора Гея в 1970 году тайна раскрылась. Это случилось следующим образом. Напомним, что стандарты стерильности и техники работы с клеточными линиями только зарождались, и некоторые ошибки всплывали только спустя годы. Так и в случае с клетками HeLa — спустя 25 лет учёные выяснили, что множество клеточных культур, происходящих из других типов тканей, включая клетки молочных желез и предстательной железы, оказались заражёнными более агрессивными и живучими клетками HeLa. Оказалось, что HeLa могут перемещаться с частицами пыли в воздухе или на недостаточно тщательно вымытых руках, и приживаться в культурах других клеток. Это вызвало большой скандал. В надежде решить проблему путем генотипирования (секвенирования генома, напомним, тогда ещё не изобрели), одна группа учёных разыскала родственников Генриетты и попросила дать им образцы ДНК семьи для того, чтобы составить карту генов. Таким образом тайное и стало явным.
Кстати, сейчас американцы переживают больше по поводу того, что семья Генриетты так и не получила компенсацию за использование клеток HeLa без согласия донора. Плюс, и по сей день семья живет в не очень-то хорошем достатке, и материальная помощь была бы очень кстати. Но все запросы упираются в глухую стену — ответчиков давно уж нет, а Медицинская академия и другие научные структуры не хотят поддерживать разговор…
Реальное бессмертие?
Злокачественная опухоль, убившая Генриетту, сделала её клетки потенциально бессмертными. Хотела ли эта женщина бессмертия? И получила ли она его? Если сравнить первую и последнюю фотографии этой статьи, возникает ощущение, как в фантастическом романе — часть живого человека, искусственно размноженная, терпит миллионы испытаний, «пробует на вкус» все лекарства перед тем, как они попадут в аптеку, раздраконивается до самых что ни на есть основ молекулярными биологами во всем мире…
Конечно, всё это не имеет никакого отношения к «жизни после жизни». Мы не допускаем, что в клетках HeLa, круглый год мучимых под ламинарами лабораторий ненасытными аспирантами, существует хоть какая-то частичка души несчастной молодой женщины. Тем не менее, хочется почтить память этой женщины, поскольку её невольный вклад в медицину неоценим — клетки, оставшиеся после неё, спасли и продолжают спасать жизней больше, чем в силах сделать любой врач.
- Zielinski S. (2010). Henrietta Lacks’ „immortal“ cells. Smithsonian Magazine;
- Smith V. (2002). Wonder woman. Baltimore City Paper.
Генриетта Лакс и ее бессмертные клетки
Одним из наиболее удивительных и важных событий во всей истории медицины и микробиологии совершенно справедливо можно считать жизнь и смерть на первый взгляд ничем не выделяющейся афроамериканской женщины Генриетты Лакс. Она родилась в США в 1920 году в многодетной семье, вскоре ее мать умерла, и она вместе со своими девятью братьями и сестрами воспитывались одним отцом, который перевез семейство к своим родственникам.
Генриетта впервые стала матерью уже в 12 лет и родила первого, как и последующих четверых детей от собственного двоюродного брата. В 14 лет она вышла за него замуж, уже имея двух детей, и на протяжении следующих пятнадцати лет жила совершенно обычной жизнью, конечно же, с поправкой на достаточно тяжелое положение афроамериканского населения в Америке тех времен. За это время она завела еще троих детей, а вот в возрасте 30 лет заметила какие-то систематические выделения на нижнем белье, с которыми она и обратилась в госпиталь Джона Хопкинса.
Исследование HeLa клетокВ результате исследований выяснилось, что у Генриетты развился рак шейки матки, который был усилен вирусом папилломы. Неудивительно, что несмотря на все предложенное лечение через 8 месяцев Генриетта умерла. Однако на этом ее история не закончилась, совсем наоборот. Дело в том, что еще при жизни Генриетты ее лечащий врач передал часть клеток ее раковой опухоли начальнику местного отдела исследований клеток ткани Джорджу Гаю. И именно он отметил уникальную природу клеток Генриетты ведь, по сути, они были бессмертны.
Дело в том, что обычные клетки человеческого тела и других живых организмом имеют определенное конечное количество делений, так называемый предел Хейфлика. Связанно это с тем, что в процессе деления на концах хромосом клеток постоянно уменьшаются в размере теломеры, до тех пор, пока клетка полностью не теряет способность деления. Предельное количество делений отличается, однако для большинства клеток человеческого организма максимумом является 52 деления.
Одновременно с этим, клетки Генриетты Лакс не имели своего предела Хейфлика и могли бесконечно делиться в питательном растворе. По факту, происходит это из-за того, что раковые опухоли достаточно часто производят в процессе роста теломеразу, специальный фермент, позволяющий теломерам постоянно сохранять свой исходный размер и не уменьшаться. Более того, клетки Генриетты имели отличную адаптируемость практически к любым условиям и делились гораздо быстрее большинства раковых клеток. Стоит также отметить, что раковые клетки, названные впоследствии HeLa (аббревиатура от имени донора) имеют аномальный кариотип, и если клетки обычного человека содержат 46 хромосом, то в клетках HeLa это количество варьируется от 49 до 78 хромосом, что уже само по себе представляет огромный интерес для науки.
Использование бессмертных клетокПолучив в свое распоряжение столь уникальные клетки, Джордж Гай быстро понял их потенциал и начал работать над созданием условий для их массового деления и развития. Дело в том, что исследовательский отдел Гая, как и многие другие научные учреждения по всему миру уже более 10 лет активно работали над созданием клеточных линий, которых требовалось просто огромное количество для проведения достоверных медицинских исследований. Однако до появления клеток HeLa все усилия были тщетными, предел Хейфлика нельзя было преодолеть, процесс выращивания клеток был долгим, а их транспортировка становилась настоящей проблемой. В то же время клетки Генриетты Лакс позволили мгновенно совершить настоящий прорыв в медицине и микробиологии, так как ученые всего мира получили бесконечное количество материала для работы.
В первую очередь данные клетки позволили создать вакцину от бушевавшего в те времена в Америке полиомиелита. На момент появления клеток HeLa вакцина от него уже была разработана Джонасом Солком, однако без многочисленных исследований он просто не мог использовать ее на живых людях. Ну а поскольку клетки HeLa оказались намного более чувствительны к вирусу полиомиелита, вопрос подходящего материала был полностью решен.
Конечно же, необходимость в большом количестве исследовательского материала побудила Гая решать вопросы массового производства данных клеток и их транспортировки. Как вскоре выяснилось, клетки HeLa оказались очень неприхотливыми к среде обитания. Если обычные клетки могут расти только на стыке питательного раствора и воздушной среды, образую пленку, то клетки HeLa спокойно развивались в любом объеме питательной среды, во много раз удешевляя их производство. Более того, после нескольких проб и попыток оказалось, что и перевозка таких клеток не составляет больших проблем, ведь они оказались намного более стойкими и невосприимчивыми к различным температурным и другим внешним фактором. В итоге клетки HeLa начали перевозить по почте, в то время как ранее обычные клетки транспортировали в специальных условиях на самолетах, так как временной фактор играл очень большую роль.
Клетки HeLa существуют и используются до сих пор, ну а поскольку их разделяли множество раз, существует сразу несколько ветвей, обладающих различными характеристиками и особенностями. Эти клетки использовали для исследования рака, СПИДа, десятков вирусных заболеваний, их использовали при испытании ядерной бомбы, они неоднократно побывали в космосе, им прививали гены живых существ и растений, заражали ими другие клетки и делали еще очень много важных вещей.
Более того, саму Генриетту, а именно уникальные клетки даже хотели выделить в качестве отдельного и совершенно нового биологического вида, из-за аномального количества хромосом. И хоть данная инициатива не была официально реализована, многие исследователи придерживаются идеи о совершенно уникальной природе клеток HeLa. В то же время сам донор Генриетта очень долго оставалась в тени. Она погибла в 1951 году, и ее лечащий врач посчитал нарушением медицинской тайны рассказывать ее семье об исследованиях ее клеток. Правда открылась им намного позже, когда исследователям понадобилось изучить всех членов семьи, и на протяжении многих лет они тщетно пытались добиться хоть каких-то денег за исследования, проводимые над клетками их матери.
Вернуться к статьямИзучение рака как искусство. BIOCAD продемонстрирует как клетки HeLa используются в онкологических исследованиях
В рамках первого в России социокультурного трипа «unTOUCHABLE ART/ИСКУССТВО неПРИКОСНОВЕННО», который проходит 6 и 7 декабря 2017 года в пространстве Порт «Севкабель» биотехнологическая компания BIOCAD продемонстрирует как “бессмертные” клетки HeLa используются по всему миру в исследованиях в области онкологии и разработке противораковых препаратов. Инсталляция “БЕССМЕРТНЫЕ” о первой в мире клеточной линии включена в новый сайнс-арт проект, который расскажет о технологиях изучения рака.
Цель социокультурного трипа — открыть новые горизонты познания и восприятия реальности, провести желающих через лабиринт тем, чтобы прикоснуться к неприкасаемым, найти ответы на актуальные для современного человека вопросы. Возможности иммерсивного театра создают эффект полного погружения — зритель становиться частью перформанса, получает доступ к предметам искусства, к героям и создателям проекта, к которым может обратиться со своей историей.
Наиболее известные среди огромного количества клеточных линий — HeLa, являются примером первой полученной в лаборатории культуры человеческих клеток и используются в биомедицинских исследованиях при разработке новых препаратов. Эти клетки часто называют «вечными», так как они могут бесконечно делиться, сохраняться на протяжении десятилетий, они не прихотливы в культивировании; хорошо переносят заморозку и консервацию. В большую науку эти клетки попали неожиданно. Они были взяты у молодой красивой афроамериканки по имени Генриетта Лакс из Южной Вирджинии, которая умерла от рака шейки матки.
Болезнь и смерть одной женщины позволила миллионам другим победить онкологию, а миру узнать о понятии бессмертности плоти. Эта история известна в медицинских профессиональных кругах, и её перформативное представление — способ привлечь внимание к проблеме заболевания раком, необходимости постоянной профилактики заболевания и его ранней диагностики.
«Мы принимаем участие в этом социокультурном проекте для того, чтобы люди понимали, что в России есть современные препараты для терапии рака, и жили без страха. Поскольку у нас в стране несколько миллионов пациентов с онкологическими заболеваниями, мы, как социально-ответственная компания, хотим, чтобы они знали о новых, доступных и эффективных методах терапии, разработать которые ученым удалось, в том числе, благодаря появлению более 60 лет назад клеточной линии HeLa. Именно тогда была заложена основная методическая база по работе с клеточными культурами, что способствовало развитию многих современных направлений биотехнологии и медицины. Сейчас ученые получают и тестируют эффективные лекарственные препараты уже с помощью сотен разных бессмертных линий, а сами клетки HeLa помогли расшифровать механизмы возникновения злокачественных опухолей и развить методы молекулярной диагностики», — рассказывает директор департамента коммуникаций BIOCAD Ирина Кенюхова.
Помимо Инсталляции в рамках трипа состоится премьера пьесы Максима Курочкина “неФОРМАТЫ”, написанная два года назад. Актеры Ольга Белинская, Петр Семак, Гала Самойлова и Дарья Степанова прочитают историю о том, как онкология меняет нашу жизнь и наши представления о ней, а также о важности ранней диагностики.
Впервые тема науки затрагивается в театральной среде в адекватной для современного общества форме, то есть с использованием непосредственно научного открытия или процесса, как базиса для перформативного акта. По утверждению представителей компании BIOCAD, инсталляция имеет под собой серьезную исследовательскую работу и опирается исключительно на достоверные данные: «Наука равнозначна искусству, и мы рассчитываем, что благодаря этому проекту, общество увидит, что она напрасно исключена из тем социально-значимых пьес».
«бессмертных» ячеек Генриетты Лакс | Наука
Медицинские исследователи используют выращенные в лаборатории человеческие клетки, чтобы изучить тонкости работы клеток и проверить теории о причинах и лечении заболеваний. Нужные им клеточные линии «бессмертны» — они могут расти бесконечно, замораживаться на десятилетия, делиться на разные партии и делиться ими между учеными. В 1951 году ученый из больницы Джона Хопкинса в Балтиморе, штат Мэриленд, создал первую бессмертную линию клеток человека с образцом ткани, взятым у молодой чернокожей женщины с раком шейки матки.Эти клетки, названные клетками HeLa, быстро стали бесценными для медицинских исследований, хотя их донор оставался загадкой на протяжении десятилетий. В своей новой книге « Бессмертная жизнь Генриетты Лакс » журналист Ребекка Склот отслеживает историю источника удивительных клеток HeLa, Генриетты Лакс, и документирует влияние клеточной линии как на современную медицину, так и на семью Лакс.
Кем была Генриетта Лакс?
Она была фермером, выращивающим черный табак из южной Вирджинии, и в 30 лет заболела раком шейки матки.Врач из Университета Джона Хопкинса взял кусок ее опухоли, ничего не сказав ей, и отправил его по коридору ученым, которые десятилетиями безуспешно пытались вырастить ткани в культуре. Никто не знает почему, но ее клетки никогда не умирали.
Почему ее клетки так важны?
Клетки Генриетты были первыми бессмертными человеческими клетками, выращенными в культуре. Они сыграли важную роль в разработке вакцины против полиомиелита. Они отправились в первые космические миссии, чтобы увидеть, что произойдет с клетками в условиях невесомости.С тех пор многие научные ориентиры использовали ее клетки, включая клонирование, генное картирование и оплодотворение in vitro.
В течение многих лет было много неразберихи относительно источника клеток HeLa. Почему?
Когда клетки были взяты, им было присвоено кодовое имя HeLa по первым двум буквам в Генриетте и Лаксе. Сегодня анонимные образцы — очень важная часть исследования клеток. Но в 1950-е врачи не сильно беспокоились об этом, поэтому они не очень заботились о ее личности.Когда некоторые представители прессы приблизились к поиску семьи Генриетты, исследователь, который выращивал клетки, придумал псевдоним — Хелен Лейн — чтобы сбить с толку СМИ. В конце концов появились и другие псевдонимы, такие как Хелен Ларсен. Ее настоящее имя не просочилось в мир до 1970-х годов.
Как вы впервые заинтересовались этой историей?
Впервые я узнал о Генриетте в 1988 году. Мне было 16 лет, и я учился на уроке биологии в муниципальном колледже. Все узнают об этих клетках по основам биологии, но что было уникальным в моей ситуации, так это то, что мой учитель действительно знал настоящее имя Генриетты и что она была чернокожей.Но это все, что он знал. В тот момент, когда я услышал о ней, я стал одержим: были ли у нее дети? Что они думают о том, что часть их матери была жива все эти годы после ее смерти? Спустя годы, когда я начал интересоваться писательством, одной из первых историй, которые я вообразил, что я пишу, была ее история. Но только когда я пошел в аспирантуру, я подумал о том, чтобы попытаться разыскать ее семью.
Как вам удалось завоевать доверие семьи Генриетты?
Отчасти потому, что я просто не хотел уходить и был полон решимости рассказать эту историю.Даже на то, чтобы убедить дочь Генриетты, Дебору, поговорить со мной, потребовался почти год. Я знал, что она отчаянно хотела узнать о своей матери. Поэтому, когда я начинал проводить собственное исследование, я рассказывал ей все, что нашел. Я поехал в Кловер, штат Вирджиния, где выросла Генриетта, разыскал ее кузенов, затем позвонил Деборе и оставил эти истории о Генриетте на ее автоответчике. Потому что часть того, что я пытался ей передать, заключалась в том, что я ничего не скрывал, чтобы мы могли узнать о ее матери вместе.Спустя год, наконец, она сказала: «Хорошо, давай займемся этим».
Когда ее семья узнала о камерах Генриетты?
Спустя двадцать пять лет после смерти Генриетты ученый обнаружил, что многие культуры клеток, которые, как считается, происходят из других типов тканей, включая клетки груди и простаты, на самом деле являются клетками HeLa. Оказалось, что клетки HeLa могут плавать на частицах пыли в воздухе, перемещаться на немытых руках и заражать другие культуры. Это стало огромным противоречием.В разгар этого одна группа ученых выследила родственников Генриетты, чтобы взять образцы в надежде, что они смогут использовать ДНК семьи, чтобы составить карту генов Генриетты, чтобы они могли сказать, какие культуры клеток были HeLa, а какие нет, чтобы приступить к устранению проблемы загрязнения.
Итак, однажды постдок позвонил мужу Генриетты. Но у него было третьеклассное образование, и он даже не знал, что такое камера. Телефонный звонок он понял так: «У нас твоя жена.Она жива в лаборатории. Мы изучали ее последние 25 лет. А теперь мы должны проверить ваших детей, чтобы узнать, есть ли у них рак ». Что совсем не то, что сказал исследователь. Ученые не знали, что семья ничего не поняла. Однако с этого момента семья оказалась втянутой в этот мир исследований, которого они не понимали, и клетки, в некотором смысле, захватили их жизнь.
Как они это сделали?
Это было наиболее верно для дочери Генриетты.Дебора никогда не знала свою мать; она была младенцем, когда умерла Генриетта. Она всегда хотела знать, кто ее мать, но никто никогда не говорил о Генриетте. Поэтому, когда Дебора узнала, что эта часть ее матери все еще жива, она отчаянно пыталась понять, что это значит: больно ли ее матери, когда ученые вводили в ее клетки вирусы и токсины? Неужели ученые клонировали ее мать? И могут ли эти клетки помочь ученым рассказать ей о ее матери, например о ее любимом цвете и о том, любит ли она танцевать.
Братья Деборы, однако, не особо задумывались о камерах, пока не узнали, что речь идет о деньгах. Клетки HeLa были первыми когда-либо купленными и проданными человеческими биологическими материалами, которые помогли запустить многомиллиардную индустрию. Когда братья Деборы узнали, что люди продавали флаконы с клетками их матери, и что семья не получила никаких денег, они очень разозлились. Семья Генриетты большую часть своей жизни прожила в бедности, и многие из них не могут позволить себе медицинскую страховку.Один из ее сыновей был бездомным и жил на улицах Балтимора. Таким образом, семья начала кампанию, чтобы получить часть того, что, по их мнению, они должны были материально. Таким образом он поглотил их жизни.
Какие уроки можно извлечь из этой книги?
Для ученых один из уроков состоит в том, что за каждым биологическим образцом, используемым в лаборатории, стоят люди. Сегодня так много науки вращается вокруг использования каких-либо человеческих биологических тканей.Для ученых клетки часто похожи на трубочки или дрозофилы — это просто неодушевленные инструменты, которые всегда есть в лаборатории. Люди, стоящие за этими образцами, часто имеют свои собственные мысли и чувства по поводу того, что должно произойти с их тканями, но их обычно не учитывают.
А для всех остальных?
История клеток HeLa и того, что произошло с Генриеттой, часто приводилась в качестве примера того, как белый ученый-расист делает что-то злонамеренное по отношению к чернокожей женщине.Но это не совсем так. Реальная история намного тоньше и сложнее. Что верно в отношении науки, так это то, что за ней стоят люди, и иногда даже при самых лучших побуждениях что-то идет не так.
Одна из вещей, которую я не хочу, чтобы люди извлекали из истории, — это идея о том, что культура тканей — это плохо. Сегодня так много медицины зависит от культуры тканей. Тесты на ВИЧ, многие основные лекарства, все наши вакцины — у нас не было бы ничего этого, если бы не ученые, собирающие клетки у людей и выращивающие их.И потребность в этих клетках будет расти, а не меньше. Вместо того, чтобы говорить, что мы не хотим, чтобы это произошло, нам просто нужно посмотреть, как это может случиться так, чтобы все были в порядке.
Как раковые клетки достигают бессмертия?
Более трети взрослого населения США заболеет раком. Только в 2018 году будет диагностировано более 1,7 миллиона новых случаев рака. Более раннее выявление и более точные варианты лечения улучшают результаты для пациентов, но, по оценкам, 14 миллионов выживших после рака живут в США, рецидив рака остается значительной угрозой.Раковые клетки, в отличие от нормальных клеток нашего тела, могут расти вечно. Бессмертие раковых клеток приводит к массивным опухолям, метастатическому распространению и потенциально повторному появлению. Научный сотрудник JAX Флорис Бартел Использует методы секвенирования нового поколения для понимания биологии опухоли мозга и механики теломер Флорис Бартел, доктор медицины получил награду «Путь к независимости» (или «K99») от Национального института рака NIH за определение того, как раковые клетки достигают бессмертия.
В конечном итоге я надеюсь, что смогу внести свой вклад в разработку новых методов лечения рака, которые уменьшают или устраняют активность теломеразы, не затрагивая нераковые клетки.
Нормальные клетки нашего тела стареют и умирают. Концы хромосом, специализированные последовательности ДНК, называемые теломерами, отслеживают клеточный возраст. С каждым делением клетки теломеры укорачиваются, пока в конечном итоге они не станут слишком короткими, чтобы защитить хромосомы, и клетка погибнет. Раки становятся бессмертными, обращая вспять нормальный процесс укорачивания теломер и вместо этого удлиняя свои теломеры.Бартель, который работает с профессором Роэлем Верхааком, доктором философии. Опухоли головного мозга, секвенирование, вычислительная биология. Роэль Верхаак, доктор философии, в кампусе геномной медицины JAX в Фармингтоне, штат Коннектикут, исследует, как раковые клетки взаимодействуют с клеточными процессами, контролирующими длину теломер.
Клеточная машина, в основном отвечающая за расширение теломер, — это протеиновая теломераза: она добавляет теломерную ДНК к концам хромосом. В нашем организме теломераза обычно отключена.Он включается при производстве сперматозоидов и яйцеклеток, а также на очень ранних этапах жизни — в клетках, которым придется много делиться. И он включается, когда клетки становятся злокачественными. Раковые клетки могут реактивировать теломеразу, изменяя ДНК вокруг одного из генов, производящих теломеразу, который называется TERT . Бартель особенно сосредоточен на определении того, как химические изменения в ДНК TERT позволяют снова включить теломеразу.
Результаты исследования Бартеля могут выявить новые способы выключения теломеразы.Превращение раковых клеток в смертные — при условии нормальной продолжительности жизни клеток, обусловленной сокращением теломер — резко изменило бы потенциал излечения, в том числе рака, с пока еще очень немногими эффективными вариантами лечения. Грант — 230 000 долларов на два года с последующей трехлетней фазой — позволяет Бартелу раскрыть, как происходит реактивация теломеразы на уровне ДНК, и создать свою независимую исследовательскую лабораторию.
«Было обнаружено, что методы лечения, направленные непосредственно на теломеразу, токсичны для нераковых клеток, и точное понимание того, как теломераза включается при раке, может позволить нам обойти это», — сказал Бартел.«В конечном итоге я надеюсь, что смогу внести свой вклад в разработку новых методов лечения рака, которые снижают или устраняют активность теломеразы, не затрагивая нераковые клетки».
«Награды NIH K99 позволяют самым талантливым молодым ученым оптимально подготовиться к карьере независимого исследователя», — сказал Верхаак. «Что касается Флориса Бартеля, я не сомневаюсь, что он продолжит делать открытия, которые в конечном итоге приведут к улучшению результатов для онкологических больных».
наследие Генриетты Лакс
КлеткиHeLa являются наиболее широко используемой линией клеток человека в биологических исследованиях, и на протяжении почти 70 лет они играли центральную роль во многих наиболее значительных биомедицинских достижениях человечества: в 1954 году эти клетки использовались для разработки вакцины против полиомиелита, в 1980-х годах. для выявления и понимания вируса иммунодефицита человека (ВИЧ) и даже в исследованиях вакцин против Covid-19.
Клетки HeLa легли в основу клинических испытаний по лечению и лечению рака, внесли свой вклад в исследования космических путешествий и позволили исследователям определить количество хромосом человека. Они помогли разработать методы лечения болезни Паркинсона и гемофилии, разработать методы замораживания клеток для хранения и открыть фермент теломеразу, который способствует старению и смерти.
Но история этих ячеек пропитана расовым неравенством. Имя HeLa относится к инициалам Генриетты Лакс, бедной чернокожей женщины, умершей от рака шейки матки в возрасте 31 года в 1951 году.Диагностируя ее болезнь, врачи больницы Джона Хопкинса в Балтиморе сделали биопсию ее раковых клеток доктору Джорджу Отто Гей, клеточному биологу из медицинской школы больницы.
Рак Лакс был уникально агрессивным случаем, и объем ее биопсии удваивался каждые 20–24 часа, тогда как другие культуры обычно вымирают.Если бы их кормили правильной смесью питательных веществ, чтобы они могли расти, клетки были бы фактически бессмертными.
Мы до сих пор не до конца понимаем, что делало их такими особенными, но, вероятно, это была комбинация агрессивности ее рака, клеток, имеющих несколько копий генома вируса папилломы человека (ВПЧ), и того факта, что у Лакса был сифилис, который ослабил бы ее иммунную систему и позволил бы раку распространиться дальше.
Гей позже размножил клетки для создания линии клеток HeLa и сделал их свободно доступными для других исследователей.Позднее эти элементы были коммерциализированы, но так и не были запатентованы.
Ни Лакс, ни ее семья не давали разрешения на сбор клеток, чего не требовалось и не требовалось в то время — и до сих пор не делается. Хотя многомиллиардная биотехнологическая промышленность была построена на клетках HeLa, ее потомки не получали финансовой компенсации и не получали консультаций в проектах, в которых они использовались.
Научный писатель и член правления Фонда Генриетты Лакс доктор Дэвид Кролл рассматривает это в перспективе: «Члены семьи Лакс проводили все эти медицинские исследования на клетках своего матриарха, но сами не могли позволить себе медицинское обслуживание.”
Ремонт открывает новые разговоры
Основанный Ребеккой Склут, научным писателем, чья книга Бессмертная жизнь Генриетты Лакс в 2010 году сделала историю Лакса широкой, фонд оказывает финансовую помощь людям, которые участвовали в исторических научных исследованиях без их ведома, согласия или выгоды, и их потомки. Фонд предоставил гранты не только потомкам Лакса, но и членам семей невольных участников исследований сифилиса в Таскиги и экспериментов с радиацией на людях, среди прочего.
Global Data Pharma
Расшифруйте будущее, чтобы получать прибыль от более быстрых и осознанных решений
На основе собственной аналитики GlobalData наши бесплатные пакеты данных для фармацевтических компаний предоставляют важную аналитическую информацию по множеству ключевых тем, нарушающих рынок и не позволяющих генеральным директорам спать по ночам.
Узнать большеВ августе прошлого года британская фирма Abcam стала первой биотехнологической компанией, сделавшей пожертвование Фонду Генриетты Лакс, который использовал клетки HeLa в своих исследованиях. За этим последовало нераскрытое шестизначное пожертвование Медицинскому институту Говарда Хьюза (HHMI) в октябре, крупнейшему некоммерческому биомедицинскому исследовательскому учреждению в США.Вместе с HHMI директор Национального института здравоохранения доктор Фрэнсис Коллинз пожертвовал фонду часть своей премии Темплтона 2020 года.
В своем заявлении, сделанном в то время, президент HHMI Эрин О’Ши сказала: «Ученые из HHMI и других наук о жизни совершили прорыв, используя клетки HeLa, и мы хотим признать огромную пользу для науки, которую сделала возможной Генриетта Лакс. После недавних, весьма заметных расистских событий сообщество HHMI объединилось, чтобы поставить новые цели в области разнообразия, равенства и интеграции.”
Репаративные пожертвования в фонд возродили разговоры об информированном согласии, когда дело доходит до медицинских исследований. Текущие правила США означают, что информированное согласие требуется только для образцов, которые считаются «идентифицируемыми» в соответствии с правилами Общего правила, что на практике означает не более чем то, что образцы не должны называться в их честь.
В 1970-х годах пациент с лейкемией по имени Джон Мур сдал образцы крови, полагая, что они будут использоваться в диагностических целях.Вместо этого материал культивировали в клеточную линию, которая стала частью заявки на патент. Мур инициировал судебный иск, но когда дело рассматривалось в Верховном суде Калифорнии, он постановил, что выброшенные ткани человека не могут считаться его личной собственностью.
Согласно законодательству США, клетки человека могут использоваться для получения миллиардов, из которых ему не должно быть ни цента.
Получить информированное согласие легче, чем сделать
Коллинз указал, что он хочет, чтобы исследовательское сообщество рассмотрело возможность изменения Общего правила, так что согласие требуется от любого, у кого взяты образцы, прежде чем указанные образцы можно будет использовать в любых клинических исследованиях.
Но многие исследователи предупреждали, что изменение Общего правила таким образом может создать чрезмерное бремя для ученых, особенно когда речь идет о клеточных линиях, таких как клетки HeLa.
«Я действительно думаю, что если какая-либо экономическая выгода исходит непосредственно от куска ткани человека, он должен иметь в этом какую-то долю, особенно если это приводит к фармацевтическому продукту или диагностике», — говорит Кролл.
«Контраргумент состоит в том, что очень сложно отследить, какой вклад конкретный кусок ткани внес в более крупную интеллектуальную собственность.Есть много компаний, которые продают интеллектуальную собственность внутри клетки HeLa. Если вы исследователь, покупающий линию клеток HeLa за 10000 долларов, в которой есть целый набор механизмов, созданных чьим-то интеллектуальным изобретением, какой процент от этой цены приходится на клетки HeLa и какой процент от этой суммы составляет интеллектуальный доход продавца. имущество?»
Даже если бы исследователи попытались получить информированное согласие при создании будущих линий клеток человека, они часто были взяты из исключительно агрессивных опухолей, таких как опухоль Лакса.Поскольку они должны быть сохранены и культивированы как можно скорее, окно, чтобы попытаться получить информированное согласие от пациента, невероятно ограничено. Если клетки погибнут в чашке Петри до того, как пациент сможет поставить свою подпись на пунктирной линии, потенциал для жизненно важных научных открытий может быть потерян.
Есть также более тревожный вопрос: стоит ли информированное согласие потенциальных выгод от медицинских исследований. Если образец клеток человека можно использовать для спасения миллионов жизней, следует ли дать ему возможность отказаться от исследования?
Мы знаем, что правильная клеточная линия может изменить ход истории — невозможно сказать, где мы были бы сегодня как вид без клеток HeLa, но есть все шансы, что нам будет намного хуже.
Возможно, никогда не будет другого открытия, такого как клетки HeLa
Однако маловероятно, что когда-либо появится еще одна клеточная линия, столь же замечательная, как клетки HeLa.
«Сейчас очень трудно использовать пожертвование ткани какого-либо человека для продукта», — говорит Кролл. «Случаи, получившие широкую огласку, являются скорее исключением, чем правилом.
«Обычно ваши ткани собирают вместе с сотнями тысяч других образцов, чтобы исследовать широкую базу людей определенной демографии в поисках риска заболевания или диагностических критериев.Очень редко ваши собственные клетки приводят к выдающимся научным открытиям «.
Возможно, наиболее важным здесь является не то, как лучше всего регулировать потенциальные будущие открытия, а то, как возместить ущерб людям, пострадавшим от прошлых открытий. Убийство Джорджа Флойда и последовавшие за этим протесты Black Lives Matter в 2020 году побудили многие медицинские учреждения изучить, как их работа основывается на расовой несправедливости и как лучше всего искупить то, как их работа извлекала выгоду из этого ущерба.
Для того, чтобы научная индустрия процветала на клетках HeLa, в то время как потомки Лакса с трудом могли позволить себе жить, это вопиющая, давняя несправедливость, коренящаяся в расизме.Расовые различия в сфере здравоохранения никуда не исчезнут, тем более, что пандемия Covid-19 продолжает непропорционально сильно влиять на чернокожих американцев, а клетки HeLa используются как жизненно важная часть исследований вакцин.
«Это действительно пародия на то, что наша система работает таким образом», — говорит Кролл. «Наш фонд действительно создан, чтобы исправить эту ситуацию для этой группы людей, под эгидой истории Генриетты Лакс как примера того, почему существует такое неравенство».
Связанные компании
Странная история Генриетты Лакс и ее «бессмертных» клеток
Генриетта Лакс, Лоретта Плезант, родилась 1 августа 1920 года в Роаноке, штат Вирджиния, в семье Элизы и Джонни Плезант.Со стороны отца она произошла от рабов, которые были заключены в тюрьму на табачной плантации, а со стороны матери она произошла от белого рабовладельца и бывшего раба, который остался на табачной плантации, чтобы работать издольщиком после освобождения.
Когда ей было четыре года, ее мать умерла, родив 10-го ребенка. Ее отец, неспособный заботиться о них всех, переехал с семьей в Кловер, штат Вирджиния, и дети переехали жить к родственникам. Лоретта, теперь по прозвищу Генриетта (никто точно не знает, почему) переехала жить к своему деду, Томми Лаксу, в помещения для рабов на плантации, принадлежавшие ее прадеду и ее двоюродному деду, деля с ней комнату двоюродный брат Дэвида «Дэй» Лакс, который позже станет ее мужем.
Лакс переехала в округ Галифакс, штат Мэриленд, с мужем и двумя детьми, где у нее было еще трое детей. Когда родился ее последний ребенок, у нее диагностировали рак шейки матки.
4 октября 1951 года, в возрасте 31 года, она умерла. Но ее клетки этого не сделали.
После того, как Лакс появился в больнице Джона Хопкинса — единственной в этом районе, где лечили чернокожих пациентов — с жалобой на «узел» внутри нее, врачи диагностировали у нее рак и начали лечить ее с помощью радиевых имплантатов, грубого лечения, которое было стандартным. в то время.В рамках ее лечения образцы тканей были собраны без ее согласия. После анализа врачи обнаружили, что ее клетки продолжали воспроизводиться еще долго после того, как клетки практически всех других образцов умирали вне своего хозяина, и с очень высокой скоростью. Клетки стали известны как «бессмертная клеточная линия HeLa».
Трудно недооценить важность этих клеток для исследований. Большинство клеток, культивируемых для лабораторных исследований, погибают в течение нескольких дней, что делает невозможным выполнение различных тестов с образцом.Теперь, имея «бессмертную» клетку, которая могла делиться и воспроизводиться, исследователи могли проводить все виды исследований, от клонирования до экстракорпорального оплодотворения, которые они не могли проводить раньше.
–
В 1954 году Джонас Солк использовал клетки Лакса в своем исследовании, разрабатывая вакцину против полиомиелита, производя эти клетки в массовом порядке, чтобы протестировать продукт своей команды. После этого ее клетки пользовались большим спросом и производились для коммерческих и медицинских исследований для ученых всего мира. Было произведено более 50 миллионов тонн ее клеток, которые были использованы в более чем 60 000 научных исследований.И все это без ее согласия и в течение многих лет без ведома ее семьи.
«Спустя двадцать пять лет после смерти Генриетты ученый обнаружил, что многие культуры клеток, которые, как считается, происходят из других типов тканей, включая клетки груди и простаты, на самом деле являются клетками HeLa», — рассказала журналу Smithsonian Magazine в 2010 году журналистка Ребекка Склот. книга Бессмертная жизнь Генриетты Лакс.
Ученые выяснили, что клетки HeLa могут перемещаться по воздуху на частицах пыли, попадать на немытые руки и заражать другие культуры в той же лаборатории.Это была огромная проблема, но одна группа исследователей подумала, что у них есть решение: они будут отслеживать семью Генриетты и использовать их ДНК для картирования ее генов, что позволит им определить, какие культуры клеток являются ее клетками, а какие нет. Возникла другая проблема; когда они действительно разыскали ее семью, они совершенно не знали, что ее камеры использовались. Ее муж, получивший образование в третьем классе, был неграмотен в науке. Довести до него ситуацию не удалось.
«бессмертных» клеток Генриетты Лакс живут в лабораториях: NPR
Бессмертная жизнь Генриетты не хватаетРебекка Склот
Твердая обложка, 368 страниц
Корона
Цена по прейскуранту: $ 26
ПРОЛОГ
Женщина на фотографии
У меня на стене фотография женщины, которую я никогда не встречал, ее левый угол порван и заклеен скотчем.Она смотрит прямо в камеру и улыбается, положив руки на бедра, в аккуратно отглаженном костюме, с накрашенными губами в темно-красный цвет. Сейчас конец 1940-х, а ей еще не исполнилось тридцати. Ее светло-коричневая кожа гладкая, ее глаза все еще молоды и игривы, не обращая внимания на опухоль, растущую внутри нее — опухоль, которая оставит ее пятерых детей без матери и изменит будущее медицины. Под фотографией написано, что ее зовут «Генриетта Лакс, Хелен Лейн или Хелен Ларсон».
Никто не знает, кто сделал этот снимок, но он сотни раз появлялся в журналах и учебниках, в блогах и на стенах лабораторий.Обычно ее называют Хелен Лейн, но часто у нее вообще нет имени. Ее просто зовут HeLa, кодовое название, данное первым в мире бессмертным человеческим клеткам — ее клеток, вырезанных из ее шейки матки всего за несколько месяцев до ее смерти.
Ее настоящее имя — Генриетта Лакс.
Я годами разглядывал эту фотографию, гадая, какую жизнь она вела, что случилось с ее детьми и что она думала о клетках шейки матки, которые живут вечно — купленных, проданных, упакованных и отправленных триллионами в лаборатории по всему миру.Я попытался представить, как она себя чувствовала, зная, что ее клетки поднялись во время первых космических миссий, чтобы увидеть, что случится с человеческими клетками в условиях невесомости, или что они помогли с одним из самых важных достижений в медицине: полиомиелитом. вакцина, химиотерапия, клонирование, генное картирование, экстракорпоральное оплодотворение. Я почти уверен, что она — как и большинство из нас — была бы шокирована, узнав, что сейчас в лабораториях растет на триллионы ее клеток больше, чем когда-либо было в ее теле.
Невозможно точно узнать, сколько клеток Генриетты живы сегодня.По оценке одного ученого, если бы вы могли сложить все когда-либо выращенные клетки HeLa на весах, они бы весили более 50 миллионов метрических тонн — немыслимое число, учитывая, что отдельная клетка почти ничего не весит. Другой ученый подсчитал, что если бы вы могли уложить все когда-либо выросшие клетки HeLa встык, они бы обернулись вокруг Земли по крайней мере три раза, охватывая более 350 миллионов футов. В расцвете сил сама Генриетта была чуть выше пяти футов ростом.
Впервые я узнал о клетках HeLa и стоящей за ними женщине в 1988 году, через тридцать семь лет после ее смерти, когда мне было шестнадцать и я сидел на уроке биологии в общественном колледже.Мой инструктор, Дональд Дефлер, лысеющий человек-гном, прошелся перед аудиторией и включил диапроектор. Он указал на две схемы, которые появились на стене позади него. Они были схемами цикла размножения клеток, но для меня они просто выглядели как неоновый беспорядок из стрелок, квадратов и кругов со словами, которые я не понимал, например «MPF, запускающий цепную реакцию белковых активаций».
Я была ребенком, которая провалила первый год в обычной государственной средней школе, потому что она так и не пришла.Я перешел в альтернативную школу, которая предлагала изучение сновидений вместо биологии, поэтому я посещала класс Дефлера для получения кредита средней школы, что означало, что я сидел в лектории колледжа в шестнадцать лет со словами вроде митоз и киназа ингибиторы летают. Я полностью потерялся.
«Мы должны запоминать все на этих диаграммах?» — крикнул один студент.
Да, сказал Дефлер, надо было запомнить диаграммы, и да, они будут на тесте, но тогда это не имело значения.Он хотел, чтобы мы поняли, что клетки — это удивительные вещи: в нашем теле их около ста триллионов, каждая настолько мала, что несколько тысяч могут уместиться на точку в конце этого предложения. Они составляют все наши ткани — мышцы, кости, кровь — которые, в свою очередь, составляют наши органы.
Под микроскопом клетка очень похожа на жареное яйцо: у нее есть белок (цитоплазма ), наполненный водой и белками для питания, и желток (ядро ), содержащий все генетическая информация, которая делает вас вами .Цитоплазма гудит, как улица Нью-Йорка. Он набит молекулами и сосудами, бесконечно перемещающими ферменты и сахара из одной части клетки в другую, перекачивая воду, питательные вещества и кислород в клетку и из нее. В то же время маленькие цитоплазматические фабрики работают 24 часа в сутки, 7 дней в неделю, вырабатывая сахар, жиры, белки и энергию, чтобы все это работало и питало ядро. Ядро — это мозг операции; внутри каждого ядра в каждой клетке вашего тела есть идентичная копия всего вашего генома.Этот геном сообщает клеткам, когда им расти и делиться, и гарантирует, что они выполняют свою работу, будь то контроль вашего сердцебиения или помощь вашему мозгу в понимании слов на этой странице.
Дефлер шагал впереди класса, рассказывая нам, как митоз — процесс деления клеток — позволяет эмбрионам вырасти в младенцев, а наши тела создают новые клетки для заживления ран или восполнения утраченной крови. Он сказал, что это было красиво, как идеально поставленный танец.
Достаточно одной маленькой ошибки в процессе деления, чтобы клетки начали бесконтрольно расти, сказал он нам. Всего один сбой фермента , всего один неправильный активационный белок , и у вас может быть рак. Митоз идет наперекосяк, и вот как он распространяется.
«Мы узнали это, изучая раковые клетки в культуре», — сказал Дефлер. Он усмехнулся и повернулся к доске, на которой огромным шрифтом написал два слова: HENRIETTA LACKS.
Генриетта умерла в 1951 году от тяжелого случая рака шейки матки, сказал он нам.Но перед ее смертью хирург взял образцы ее опухоли и поместил их в чашку Петри. Ученые десятилетиями пытались сохранить человеческие клетки живыми в культуре, но в конечном итоге все они умерли. Генриетты были другими: они воспроизводили целое поколение каждые двадцать четыре часа, и они никогда не останавливались. Они стали первыми бессмертными человеческими клетками, выращенными в лаборатории.
«Клетки Генриетты теперь живут вне ее тела намного дольше, чем когда-либо внутри него», — сказал Дефлер.Он сказал нам, что если мы пойдем практически в любую лабораторию по культивированию клеток в мире и откроем для нее морозильники, мы, вероятно, найдем миллионы — если не миллиарды — клеток Генриетты в маленьких пузырьках на льду.
Ее клетки были частью исследования генов, вызывающих рак, и генов, подавляющих его; они помогли разработать лекарства для лечения герпеса, лейкемии, гриппа, гемофилии и болезни Паркинсона; и они использовались для изучения переваривания лактозы, заболеваний, передающихся половым путем, аппендицита, долголетия человека, спаривания комаров и негативных клеточных эффектов работы в канализации.Их хромосомы и белки были изучены с такой детальностью и точностью, что ученые знают каждую их причуду. Как морские свинки и мыши, клетки Генриетты стали стандартной лабораторной рабочей лошадкой.
«Клетки HeLa были одним из самых важных событий, произошедших с медициной за последние сто лет», — сказал Дефлер.
Затем, как ни в чем не бывало, почти запоздало, он сказал: «Она была темнокожей женщиной». Он стер ее имя одним быстрым движением и сдул мел со своих рук.Урок закончился.
Пока другие студенты выходили из комнаты, я сидел и думал: Вот и все? Это все, что мы получаем? В этой истории должно быть что-то большее.
Я последовал за Дефлером в его офис.
«Откуда она?» Я спросил. «Знала ли она, насколько важны ее клетки? Были ли у нее дети?»
«Хотел бы я тебе сказать, — сказал он, — но о ней никто ничего не знает».
После уроков я побежал домой и бросился на кровать с учебником биологии.Я поискал в указателе «клеточную культуру», и там она была, небольшая скобка:
В культуре раковые клетки могут делиться бесконечно долго, если у них есть постоянный запас питательных веществ, и, следовательно, они считаются «бессмертными». . » Ярким примером является линия клеток, которая воспроизводится в культуре с 1951 года. (Клетки этой линии называются клетками HeLa, потому что их первоначальным источником была опухоль, удаленная от женщины по имени Генриетта Лакс.)
Вот и все. Я поискал HeLa в энциклопедии моих родителей, затем в своем словаре: Нет, Генриетта.
Когда я закончил среднюю школу и прошел через колледж, чтобы получить степень биологии, клетки HeLa были вездесущи. Я слышал о них в гистологии, неврологии, патологии; Я использовал их в экспериментах по взаимодействию соседних клеток. Но после мистера Дефлера Генриетту никто не упомянул.
Когда в середине девяностых я получил свой первый компьютер и начал пользоваться Интернетом, я искал информацию о ней, но нашел только запутанные отрывки: на большинстве сайтов говорилось, что ее зовут Хелен Лейн; некоторые говорили, что она умерла в тридцатых годах; другие говорили о сороковых, пятидесятых или даже шестидесятых годах.Одни говорили, что ее убил рак яичников, другие — рак груди или шейки матки.
В конце концов я нашел несколько журнальных статей о ней семидесятых. Ebony процитировал слова мужа Генриетты: «Все, что я помню, это то, что у нее была эта болезнь, и сразу после ее смерти они позвонили мне в офис, чтобы получить разрешение на взятие какого-либо образца. Я решил не позволять им. » Jet сказал, что семья была разгневана — рассержена тем, что клетки Генриетты продаются по двадцать пять долларов за флакон, и рассержена тем, что статьи о клетках были опубликованы без их ведома.В нем говорилось: «Бить их по затылку было мучительным чувством, что наука и пресса воспользовались ими».
Во всех статьях были фотографии семьи Генриетты: ее старший сын сидит за своим обеденным столом в Балтиморе и смотрит учебник генетики. Ее средний сын в военной форме улыбается и держит на руках ребенка. Но одна фотография выделялась больше, чем любая другая: на ней дочь Генриетты, Дебора Лакс, окружена семьей, все улыбаются, обнимаются друг с другом, глаза сияют и взволнованы.Кроме Деборы. Она стоит на переднем плане и смотрит одна, как будто кто-то вставил ее в фотографию постфактум. Ей двадцать шесть лет, она красива, с короткими каштановыми волосами и кошачьими глазами. Но эти глаза пристально и серьезно смотрят в камеру. Подпись гласила, что всего за несколько месяцев до этого семья узнала, что клетки Генриетты все еще живы, но на тот момент она была мертва двадцать пять лет назад.
Во всех историях упоминалось, что ученые начали исследования детей Генриетты, но Лаксы, похоже, не знали, для чего это исследование.Они сказали, что их проверяют, чтобы узнать, есть ли у них рак, убивший Генриетту, но, по словам репортеров, ученые изучали семью Лакс, чтобы узнать больше о клетках Генриетты. Истории цитировали ее сына Лоуренса, который хотел знать, означает ли бессмертие клеток его матери, что он тоже может жить вечно. Но один из членов семьи остался безмолвным: дочь Генриетты, Дебора.
Когда я закончил аспирантуру, изучая письмо, я зациклился на идее когда-нибудь рассказать историю Генриетты.В какой-то момент я даже позвонил в справочную службу в Балтиморе, разыскивая мужа Генриетты, Дэвида Лакса, но его не было в списке. У меня была идея написать книгу, которая будет биографией как клеток, так и женщины, от которой они произошли — чьей-то дочери, жены и матери.
Я не мог себе этого представить тогда, но этот телефонный звонок ознаменовал бы начало десятилетнего приключения в научных лабораториях, больницах и психиатрических учреждениях с персонажами, среди которых были нобелевские лауреаты, клерки продуктовых магазинов, осужденные преступники. , и профессиональный мошенник.Пытаясь разобраться в истории клеточных культур и сложных этических дебатах вокруг использования человеческих тканей в исследованиях, меня обвиняли в заговоре и врезали в стену как физически, так и метафорически, и в конце концов я оказался на Получивший конец чего-то очень похожего на экзорцизм. В конце концов я встретил Дебору, которая оказалась одной из самых сильных и стойких женщин, которых я когда-либо знал. Мы сформировали глубокую личную связь, и постепенно, не осознавая этого, я стал персонажем ее истории, а она — моей.
Дебора и я происходили из очень разных культур: я вырос белым и агностиком на Тихоокеанском Северо-Западе, мои корни наполовину нью-йоркский еврей, наполовину протестант со Среднего Запада; Дебора была глубоко религиозной чернокожей христианкой с Юга. Я имел тенденцию выходить из комнаты, когда в разговоре зашла речь о религии, потому что это доставляло мне дискомфорт; Семья Деборы стремилась к проповедям, исцелениям верой и иногда к вуду. Она выросла в районе для чернокожих, который был одним из самых бедных и опасных в стране; Я вырос в безопасном, тихом районе среднего класса в преимущественно белом городе и ходил в среднюю школу с двумя чернокожими учениками.Я был научным журналистом, который называл все сверхъестественное «чепухой»; Дебора считала, что дух Генриетты живет в ее камерах, контролируя жизнь любого, кто пересекает ее пути. Включая меня.
«Как еще вы объясните, почему ваш учитель естествознания знал ее настоящее имя, когда все называли ее Хелен Лейн?» — сказала бы Дебора. «Она пыталась привлечь ваше внимание». Это мышление применимо ко всему в моей жизни: когда я вышла замуж во время написания этой книги, это произошло потому, что Генриетта хотела, чтобы кто-то заботился обо мне, пока я работаю.Когда я развелся, это произошло потому, что она решила, что он мешает книге. Когда редактор, настаивавший на том, чтобы я убрал семью Лаксов из книги, был ранен в результате загадочного происшествия, Дебора сказала, что именно это происходит, когда вы бесите Генриетту.
Лаксы бросили вызов всему, что, как мне казалось, я знал о вере, науке, журналистике и расе. В конечном итоге эта книга — результат. Это не только история клеток HeLa и Генриетты Лакс, но и история семьи Генриетты — особенно Деборы — и их пожизненной борьбы за примирение с существованием этих клеток и науки, которая сделала их возможными.
Выдержки из Бессмертная жизнь Генриетты Лакс Ребекка Склоот Авторские права 2010 Ребекка Склоот. Взято с разрешения Crown, подразделения Random House Inc. Все права защищены.
клеток HeLa (1951) | Британское общество иммунологии
Генриетта Лакс, чернокожая женщина, 31-летняя мать пятерых детей, умерла от рака шейки матки в 1951 г. . Ее имя и память живут в форме замечательной линии непрерывно делящихся клеток, которые достигли, во всех отношениях, «бессмертия».Ее раковые клетки продолжали жить и после ее смерти в лабораториях по всему миру, размножаясь настолько широко, что уложенные из конца в конец, их можно было трижды обернуть вокруг Земли.
Когда Генриетта посетила онкологическую клинику Джона Хопкинса в Балтиморе в январе 1951 года, единственную больницу в этом районе, где лечили афроамериканцев в то время, она мало понимала, что сможет достичь своего рода бессмертия. Ее хирург, Говард Джонс, без ее ведома и согласия взял биопсию ткани ее раковой матки, которую передали Джорджу Отто Гею, врачу и исследователю рака из той же больницы в Балтиморе, который был поражен способностью клеток воспроизводиться в лабораторная культура.
Обычно раковые клетки делятся несколько раз и умирают, прежде чем с ними можно будет провести какие-либо достойные исследования. Но Генриетта просто продолжала делить и делить, пока они получали правильную смесь питательных веществ для их роста. Раковые клетки Генриетты стали первой человеческой «клеточной линией», созданной в культуре, и Гей назвал их в честь первых двух букв ее имени — HeLa (произносится как «хи-ла»).
КлеткиHeLa с тех пор стали наиболее широко используемой линией клеток человека в биологических исследованиях и сыграли решающую роль во многих биомедицинских открытиях за последние полвека.Джонас Солк, например, использовал их в 1954 году для разработки вакцины против полиомиелита, а в 1980-х годах исследователи СПИДа использовали их для идентификации и выделения вируса иммунодефицита человека (ВИЧ), в то время как в последние годы клетки HeLa сыграли решающую роль в «омической» революции. от геномики до транскриптомики и протеомики.
Было опубликовано около 70 000 исследований с использованием клеток HeLa, и они широко используются в области иммунологии. По крайней мере, две Нобелевские премии были присуждены недавно за исследования с участием клеток HeLa, одна — о связи между вирусом папилломы человека и раком шейки матки (Харальд цур Хаузен, 2008 г.), которая была вручена первооткрывателям ВИЧ (Люк Монтанье и Франсуаза Барре-Синусси. ), а другой — о роли фермента теломеразы в предотвращении деградации хромосом (Элизабет Блэкберн, Кэрол Грейдер и Джек Шостак, 2009).
Что касается большой семьи Генриетты, то они до недавнего времени держались в неведении относительно того, что случилось с невольным наследством их предков медицинской науке, шокирующим упущением, которое привело в США к изменению основных этических правил, касающихся приема и использования больничных биопсий без информированного согласия. Историю жизни Лакса и загробной жизни можно лучше понять «Бессмертная жизнь Генриетты Лакс», роман, написанный Ребеккой Склут.
Поколение бессмертных клеточных линий
Нормальные клетки неспособны к репликации после нескольких раундов пролиферации (так называемого предела Хейфлика), поскольку с каждым раундом пролиферации теломеры укорачиваются.Когда теломеры достигают критически уменьшенной длины, запускается повреждение ДНК, ведущее к клеточному старению.
Следовательно, если вы попытаетесь культивировать первичную популяцию клеток, она в конечном итоге погибнет, если с клетками не будут каким-либо образом манипулировать, чтобы обойти процесс старения и стать бессмертными. Здесь мы обсуждаем различные способы преодолеть предел сена и вызвать бессмертие культивируемых клеток.
Источники бессмертия
Спонтанно увековеченные клетки
Лучшим примером этого могут быть раковые клетки, которые, возможно, претерпели генетические изменения, чтобы противостоять старению, и бессмертны.Однако многие линии раковых клеток могут не иметь этих изменений, на самом деле Джорджу Гей, ученому, который создал первую бессмертную и, возможно, самую известную линию клеток: клетки HeLa, пришлось протестировать сотни линий рака, прежде чем он наткнулся на высокометапластический яичник. клетки Генриетты Лакс. Таким образом, могут потребоваться другие методики, чтобы помочь даже раковым клеткам стать бессмертными.
Представьте вирусный ген, который перекрывает клеточный цикл
Многие вирусные гены влияют на клеточный цикл и, таким образом, могут использоваться для преодоления старения путем устранения биологических тормозов контроля пролиферации.Многие из них являются генами-супрессорами опухолей, поскольку они требуют подавления для возникновения туморогенеза. Наиболее распространенным из них является сверхэкспрессия Большого Т-антигена обезьяньего вируса (SV-40), который репрессирует гены ретинобластомы (Rb) и p53, которые являются критическими регуляторами клеточного цикла.
Одним из примеров клеточной линии, иммортализованной SV40, является HEK293T, который также известен как клетки 293T, клеточная линия, широко используемая для экспрессии вирусных частиц и для многих клеточных анализов, поскольку они очень легко трансфицируются.Другие вирусные гены включают гены вируса папилломы человека (HPV), такие как E6 и E7, которые также нацелены на Rb и p53.
Экспрессия генов, придающих бессмертие
Самый известный ген бессмертия — теломераза (hTERT). Рибонуклеопротеин, теломераза способна расширять последовательность ДНК теломер, тем самым замедляя процесс старения и позволяя клеткам подвергаться бесконечным клеточным делениям. Действительно, недавно теломераза была объявлена потенциальным механизмом обращения вспять старения.Проблема с использованием теломеразы для обращения вспять старения заключается в том, что повышенная экспрессия теломеразы также может вызывать рост опухоли. Действительно, многие из тех же генов, которые использовались для создания иммортализованных клеточных линий, таких как hTERT и SV40, индуцируют образование опухолей. Таким образом, неудивительно, что hTERT часто сверхэкспрессируется в опухолях человека, что придает один из ключевых признаков рака: безудержное разрастание. Именно для этого мы используем его при увековечивании первичной клеточной линии!
Комбинация инактивации супрессора опухолей и экспрессии теломеразы
В некоторых типах клеток использование только одного метода иммортализации может дать небольшое количество клеток, которые стали бессмертными.Поэтому, в зависимости от вашей клеточной линии, может быть полезно комбинировать как подавление супрессора опухоли (например, ингибиторы клеточного цикла, упомянутые выше), так и экспрессию hTERT, чтобы увековечить большее количество клеток. Этот двойной метод также предлагается, если вы хотите как увековечить, так и трансформировать (то есть сделать канцерогенными) свою клеточную линию, поскольку данные свидетельствуют о том, что некоторые клеточные линии не подвергаются эффективной трансформации без некоторой иммортализации.
Как ввести бессмертие в первичную клеточную линию
Многие из вышеперечисленных источников бессмертия основаны на генетических манипуляциях с вашей первичной клеточной линией.Это требует введения чужеродной ДНК в ваши клетки. Поскольку многие первичные клеточные линии чрезвычайно трудно трансфицировать, самый простой и эффективный способ внести генетические изменения в первичную клеточную линию — это вирусная инфекция.
Самый популярный метод — это лентивирусы с недостаточной репликацией, поскольку они относительно безопаснее, чем аденовирусы, которые обладают способностью повторно инфицировать клетки и, таким образом, содержат живой вирус в течение гораздо более длительного периода времени. Если вам нужна дополнительная информация о производстве лентивирусов, посетите страницу ресурсов Addgene Lentiviral.Ретровирусы также можно использовать для трансфекции клеток, однако они могут инфицировать только активно делящиеся клетки, тем самым уменьшая количество клеток, которые могут быть трансдуцированы вирусом.
Предупреждение: бессмертие — не лучший путь!
Внося генетические изменения в свои клетки, вы можете существенно изменить фенотип своей клеточной линии. Хотя это действительно делает вашу клеточную линию более полезной в некотором смысле: это может сделать ваши клетки более однородными, что позволяет воспроизводить результаты, вы можете создавать большие запасы клеток для будущего использования, и их может быть легче экспериментально, но есть еще много преимуществ для с использованием первичных клеточных линий.
По мере того, как первичные линии приспосабливаются к культивированию и увековечению, популяции клеток и клеточные механизмы изменяются. Это может запутать ваши эксперименты и привести к неубедительным или ошибочным результатам. Кроме того, ведется много споров о том, насколько точно иммортализованные клетки моделируют настоящую ткань. Например, хотя это спорно, маловероятно, что SV40 может инфицировать людей, хотя механизм действия мутаций SV40: p53 и Rb может быть очень распространенными мутациями в опухолях человека. Таким образом, важно определить лучшую генетическую манипуляцию для увековечения вашего типа клеток.
Следовательно, хотя иммортализованные клетки чрезвычайно полезны для экспериментальных исследований, при их использовании следует принять некоторые предостережения. Как и в случае с любой экспериментальной моделью, иммортализованные клетки — это просто модель для вашей предполагаемой клеточной системы.
Дополнительное чтение:
Ребекка Склот — «Бессмертная жизнь Генриетты Лакс»
Это обязательное чтение для всех начинающих и опытных биологов. В хорошо проработанной книге описывается идентификация клеток HeLa, их научная ценность, а также этические дилеммы, которые они выявили, и упор на семью Лаксов.
Ссылки:
ATCC: клетки HEK293T (ATCC CRL-3216)
Гарбе и др. (1999) Вирусные онкогены ускоряют превращение в бессмертие культивируемых условно бессмертных эпителиальных клеток молочной железы человека. Онкоген . 18 (13): 2169
Callaway, E (2010) Nature News: Теломераза обращает вспять процесс старения.
Ханахан и Вайнберг (2011) Признаки рака: следующее поколение. Ячейка . 144 (5): 646.
Zhu et al. (1991). Способность большого Т-антигена обезьяньего вируса 40 иммортализовать первичные фибробласты эмбриона мыши косегрегирует с его способностью связываться с р53. Журнал вирусологии . 65 (12): 6872.
Redell (1999) Роль старения и иммортализации в канцерогенезе. Канцерогенез . 21 (3): 477.
Протоколы и ресурсы Addgene Lentiviral
Нельсон (2001) Дебаты о связи между SV40 и раком человека продолжаются.